题目内容
【题目】张老师将一包铜粉和锌粉的混合物8克与100克稀硫酸放在敞口的烧杯中,恰好完全反应后称得烧杯中剩余物质的质量为107.8克。(相对原子质量:Zn:65,H:1,S:32,O:16)
(1)该反应中产生氢气的质量是______克;
(2)原稀硫酸中溶质的质量分数是多少______?
【答案】0.2 9.8%
【解析】
根据金属活动性顺序表可知,锌粉可以和稀硫酸反应,铜粉不和稀硫酸反应。
解:(1)由质量守恒定律可知,氢气为气体,反应后总质量的减少量即为氢气的质量,故氢气的质量为:100g+8g-107.8g=0.2g;
(2)设原稀硫酸中溶质的质量是x,则有
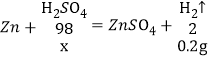
![]() 得x=9.8g,
得x=9.8g,
故原稀硫酸中溶质的质量分数是![]() ×100%=9.8%。
×100%=9.8%。
答:该反应中产生氢气的质量是0.2g;原稀硫酸中溶质的质量分数是9.8%。

练习册系列答案
 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目