题目内容
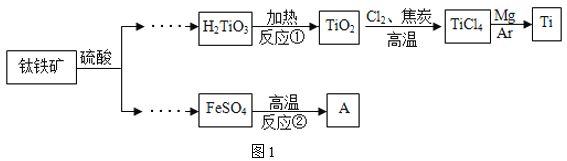
【题目】金属钛广泛用于航空航天工业、化工、医疗等领域。用钛铁矿(主要成分为 FeTiO3)制取钛并获得副产品A的主要工艺流程如图1所示:
请回答下列问题:
(1)构成金属钛的微粒是_____(填“分子”“原子”或“离子”),H2TiO3中钛元素的化合价为_____;
(2)反应②需持续通入氩气,氩气的作用是_____;
(3)反应③的产物除红色固体A外,还有两种组成元素相同且相对分子质量相差16的气体,则该反应的化学方程式为_____;
(4)反应①②③中属于分解反应的是_____(填“①”“②”“③”);
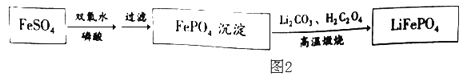
(5)对反应③进行改进,可直接生产锂离子电池的电极材料 LiFePO4,工艺流程如图2所示:写出“高温煅烧”由FePO4制备 LiFePO4的化学方程式_____。
【答案】原子 +4价 隔绝空气或者保护气 2FeSO4![]() Fe2O3+SO2↑+SO3↑ ①③ 2FePO4+Li2CO3+H2C2O4
Fe2O3+SO2↑+SO3↑ ①③ 2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑
2LiFePO4+H2O+3CO2↑
【解析】
根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息。
(1)金属是原子直接构成的,所以构成金属钛的微粒是原子。H2TiO3中氢元素为+1价,而氧元素为﹣2价,根据化合物中正负化合价的代数和为零可得钛元素的化合价为+4价;故填:原子;+4
(2)反应②需持续通入氩气,由于氩气性质稳定,所以氩气的作用是隔绝空气或者保护气;故填:隔绝空气或者保护气
(3)反应③的产物除红色固体A外,还有两种组成元素相同且相对分子质量相差16的气体根据元素守恒可知为含硫的氧化物,为二氧化硫和三氧化硫,对应的化学方程式为 2FeSO4![]() Fe2O3+SO2↑+SO3↑;故填:2FeSO4
Fe2O3+SO2↑+SO3↑;故填:2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
(4)反应①是H2TiO3分解为二氧化钛和水,为分解反应;反应②为二氧化钛和氯气以及碳反应生成氯化钛和一氧化碳,不属于基本反应类型;③2FeSO4![]() Fe2O3+SO2↑+SO3↑,为分解反应。所以属于分解反应的是①③;故填:①③
Fe2O3+SO2↑+SO3↑,为分解反应。所以属于分解反应的是①③;故填:①③
(5)“高温煅烧”由FePO4制备LiFePO4是FePO4和Li2CO3以及H2C2O4在高温下生成LiFePO4和H2O以及CO2.制备LiFePO4化学方程式2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑。故填:2FePO4+Li2CO3+H2C2O4
2LiFePO4+H2O+3CO2↑。故填:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑
2LiFePO4+H2O+3CO2↑

【题目】某兴趣小组对蜡烛燃烧火焰的焰心进行了以下探究.
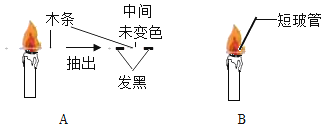
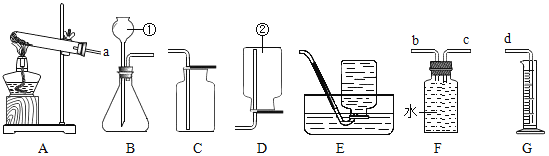
(1)点燃蜡烛,将一根小木条迅速平放入火焰中,约1s后取出,现象如图A,这证明焰心_____.
(2)向焰心处斜向插入一支短玻璃管,发现玻璃管中无明显现象(如图B),在玻璃管的上口点燃,上口产生火焰,这说明焰心物质的性质是:_____(物理性质)、_____(化学性质).
(3)猜想和验证.
猜想 | 操作 | 现象 | 结论 |
假设①:焰心气体含CO2 | 在未点燃的短玻璃管上口_____ | _____ | 假设①不成立 |
假设②:焰心气体含石蜡蒸汽 | 取一较长的细玻璃管,用湿冷毛巾包住中部,将玻璃管下端插入焰心,上端试用火焰点燃 | _____ | 假设②成立 |
取下长玻璃管,打开湿毛巾 | _____ |
(4)若蜡烛的主要成分是石蜡,则其燃烧的反应文字表达式为_____.