题目内容
玉树地震发生后,全国上下众志成城,抗震救灾.在灾后的防疫工作中,常用二氧化氯(ClO2)作消毒剂.ClO2是一种橙绿色、有刺激性气味的气体,11℃以下为红色液体,易溶于水,见光易分解.可用氯酸钠(NaClO3)与浓盐酸反应制取ClO2,反应的化学方程式如下:2NaClO3+4HCl═2ClO2↑+Cl2↑+2X+2NaCl.
(1)根据以上信息,请你总结出ClO2的化学性质______;
(2)推断上述反应中X的化学式______,你推断的依据是______.玉树发生了地震后,全国人民抗震救灾,众志成城.为确保大灾之后无大疫,卫生部门用优氯剂(含氯元素______)、漂白粉对饮用水______等进行消毒.漂白粉的有效成分是Ca(ClO)2,氯元素的化合价是______.
(3)我市派遣专业人员赶赴灾区,协助做好饮用水安全工作.自来水厂主要通过 ①吸附沉淀(用明矾) ②投药消毒(用漂白粉等) ③静置沉淀 ④过滤等对自然水进行净化,其合理的步骤顺序是______(填序号);可用______试纸检测水酸碱度是否达到标准;
(4)灾后重建工作:迅速搭建了一批简易安置房,安置房用外层是钢板中间填充泡沫塑料的夹心板做墙体.为防止钢板生锈,延长夹心板的使用寿命,下列措施合理的是______;
A.表面喷漆 B.经常酸洗 C.经常水洗
(5)国家药监局公布的抗震救灾急需药械目录中包括:一次性防护服、活性炭防护口罩、骨科内外固定材料等.其中防护口罩主要是利用活性炭的______性.
(6).为防止日本强地震和海啸引起的病菌传播,防疫人员大量使用了“漂白粉”来杀菌消毒,“漂白粉”的有效成分为次氯酸钙化学式为Ca(ClO)2.请回答:
①次氯酸钙中金属元素是______(写元素符号);氧、氯、钙三种元素的质量比为______;
②次氯酸钙中氯元素的质量分数是______(精确到0.1%);
③若灾区饮用水每50kg至少需要漂白粉250g,则消毒一桶水(约20kg)至少需要加入漂白粉______g?
解:(1)二氧化氯见光易分解,需要通过化学反应才能表现出来,属于化学性质.
(2)根据反应的化学方程式2NaClO3+4HCl═2ClO2↑+Cl2↑+2X+2NaCl,反应物中钠、氯、氧、氢原子个数分别为2、6、6、4,反应后的生成物中钠、氯、氧、氢原子个数分别为2、6、4、0,根据反应前后原子种类、数目不变,则2X中含有4个氢原子和2个氧原子,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为H2O.推断的依据是质量守恒定律.氯元素的元素符号为:Cl;水的化学式为:H2O;钙元素显+2价,氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)+2x+(-2)×2=0,则x=+1价.
(3)地震灾区的水受到严重污染,必须净化后才能饮用,一般先将水静置,让大颗粒泥沙沉降,接着再加入明矾,使小颗粒不溶物聚集,再过滤除掉不溶物,最后进行消毒,才能饮用,因此正确的排列顺序是③①④②;检测水酸碱度可用pH试纸.
(4)表面喷漆能隔绝氧气和水分,能防止生锈;经常酸洗会加速生锈,因为酸性环境能加速金属制品生锈;经常水洗,会使钢板满足与水、氧气接触的锈蚀条件,促进锈蚀.
(5)活性炭具有吸附性,能吸附色素和异味,故可用于防护口罩.
(6)①由次氯酸钙的化学式可知,它是由钙、氯、氧三种元素组成的,其中钙属于金属元素;钙、氯、氧三种元素的质量比为40:(35.5×2):(16×2)=40:71:32.
②次氯酸钙的相对分子质量为:40+(35.5+16)×2=143,次氯酸钙中氯元素的质量分数为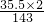 ×100%=49.7%.
×100%=49.7%.
③饮用水每50kg至少需要漂白粉250g,则消毒一桶水(约20kg)至少须加漂白粉=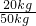 ×250g=100g.
×250g=100g.
故答案为:(1)见光易分解;(2)H2O;质量守恒定律;Cl;H2O;+1;(3)③①④②;pH;(4)A;(5)吸附;(6)Ca;40:71:32;①②49.7%;③100.
分析:(1)题目中给出的信息既有二氧化氯的物理性质,又有其化学性质,根据物理性质和化学性质的区别,找出属于其化学性质的内容即可.
(2)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.根据元素符号、化学式的书写方法、化合价的原则等进行分析解答即可.
(3)根据水的净化步骤进行分析解答,测定溶液的酸碱度最简单的方法是使用pH试纸.
(4)根据防止铁制品锈蚀的原理进行分析解答.
(5)活性炭具有吸附性,能吸附色素和异味.
(6)①根据次氯酸钙的化学式可确定次氯酸钙的组成元素;根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
②根据化合物中元素的质量分数=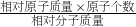 ×100%,进行分析解答.
×100%,进行分析解答.
③根据每50kg饮用水至少需要漂白粉250g的质量关系,判断消毒20kg的一桶水需要漂白粉的质量.
点评:本题难度不大,掌握物理性质和化学性质的区别方法、质量守恒定律、化学用语的书写、水的净化、防止铁制品锈蚀的原理、有关化学式的计算等即可正确解答本题.
(2)根据反应的化学方程式2NaClO3+4HCl═2ClO2↑+Cl2↑+2X+2NaCl,反应物中钠、氯、氧、氢原子个数分别为2、6、6、4,反应后的生成物中钠、氯、氧、氢原子个数分别为2、6、4、0,根据反应前后原子种类、数目不变,则2X中含有4个氢原子和2个氧原子,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为H2O.推断的依据是质量守恒定律.氯元素的元素符号为:Cl;水的化学式为:H2O;钙元素显+2价,氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)+2x+(-2)×2=0,则x=+1价.
(3)地震灾区的水受到严重污染,必须净化后才能饮用,一般先将水静置,让大颗粒泥沙沉降,接着再加入明矾,使小颗粒不溶物聚集,再过滤除掉不溶物,最后进行消毒,才能饮用,因此正确的排列顺序是③①④②;检测水酸碱度可用pH试纸.
(4)表面喷漆能隔绝氧气和水分,能防止生锈;经常酸洗会加速生锈,因为酸性环境能加速金属制品生锈;经常水洗,会使钢板满足与水、氧气接触的锈蚀条件,促进锈蚀.
(5)活性炭具有吸附性,能吸附色素和异味,故可用于防护口罩.
(6)①由次氯酸钙的化学式可知,它是由钙、氯、氧三种元素组成的,其中钙属于金属元素;钙、氯、氧三种元素的质量比为40:(35.5×2):(16×2)=40:71:32.
②次氯酸钙的相对分子质量为:40+(35.5+16)×2=143,次氯酸钙中氯元素的质量分数为
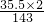 ×100%=49.7%.
×100%=49.7%.③饮用水每50kg至少需要漂白粉250g,则消毒一桶水(约20kg)至少须加漂白粉=
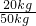 ×250g=100g.
×250g=100g.故答案为:(1)见光易分解;(2)H2O;质量守恒定律;Cl;H2O;+1;(3)③①④②;pH;(4)A;(5)吸附;(6)Ca;40:71:32;①②49.7%;③100.
分析:(1)题目中给出的信息既有二氧化氯的物理性质,又有其化学性质,根据物理性质和化学性质的区别,找出属于其化学性质的内容即可.
(2)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.根据元素符号、化学式的书写方法、化合价的原则等进行分析解答即可.
(3)根据水的净化步骤进行分析解答,测定溶液的酸碱度最简单的方法是使用pH试纸.
(4)根据防止铁制品锈蚀的原理进行分析解答.
(5)活性炭具有吸附性,能吸附色素和异味.
(6)①根据次氯酸钙的化学式可确定次氯酸钙的组成元素;根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
②根据化合物中元素的质量分数=
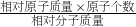 ×100%,进行分析解答.
×100%,进行分析解答.③根据每50kg饮用水至少需要漂白粉250g的质量关系,判断消毒20kg的一桶水需要漂白粉的质量.
点评:本题难度不大,掌握物理性质和化学性质的区别方法、质量守恒定律、化学用语的书写、水的净化、防止铁制品锈蚀的原理、有关化学式的计算等即可正确解答本题.

练习册系列答案
相关题目
 玉树发生了大地震,全国人民抗震救灾,众志成城,彰显了中华民族的巨大凝聚力.请回答下列问题:
玉树发生了大地震,全国人民抗震救灾,众志成城,彰显了中华民族的巨大凝聚力.请回答下列问题: