题目内容
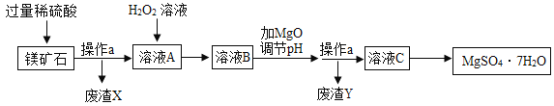
【题目】2018年春节期间播出的《舌尖3》,让籍籍无名的章丘铁锅名声大振,章丘手工铁锅制造需要历经十二道工序,再过十八遍火候,一千度高温锤炼,经受三万六千次锻打,其炉渣中主要含FeO、Fe2O3,还有一定量既不溶于水,也不与稀酸反应的杂质。现按如图工艺流程,用炉渣制备绿矾(FeSO47H2O)。请按要求回答问题:
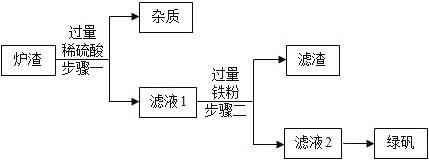
查阅资料:氧化亚铁与稀硫酸、铁与硫酸铁反应均可生成硫酸亚铁。
(1)步骤一中,发生反应的一个化学方程式为_____。
(2)步骤一中的操作名称是_____,为提高步骤一的反应速率,可采取的措施有增大硫酸的浓度,升高反应物的温度,还可以采取_____(写1条,不考虑“搅拌”和“使用催化剂”)。
(3)步骤二中有气体生成的化学反应方程式为_____,无气体生成的化学反应方程式为_____,测得滤液2的pH明显大于滤液1,其原因是_____。
(4)滤液2得到绿矾可以采取的方法是_____。
【答案】Fe2O3+3H2SO4===Fe2(SO4)3+3H2O或FeO+H2SO4===FeSO4+H2O 过滤 把炉渣粉碎增大与硫酸的接触面积 Fe+H2SO4===FeSO+H2↑ Fe+Fe2(SO4)3===3FeSO4 铁消耗了过量的硫酸,使溶液的酸性减弱 蒸发溶剂
【解析】
(1)步骤一中,发生反应的一个化学方程式为Fe2O3+3H2SO4===Fe2(SO4)3+3H2O或FeO+H2SO4===FeSO4+H2O;
(2)步骤一中的操作名称是过滤;为提高步骤一的反应速率,可采取的措施有增大硫酸的浓度,升高反应物的温度,还可以采取把炉渣粉碎增大与硫酸的接触面积;
(3)步骤二中有气体生成的化学反应方程式为Fe+H2SO4===FeSO+H2↑;无气体生成的化学反应方程式为Fe+Fe2(SO4)3===3FeSO4;测得滤液2的pH明显大于滤液1,其原因是铁消耗了过量的硫酸,使溶液的酸性减弱;
(4)滤液2得到绿矾可以采取的方法是蒸发溶剂。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】难溶性杂卤石属于“呆矿”,主要成分有K2SO4、MgSO4、CaSO4、不溶性杂质等(假设杂质不参加反应),为能充分利用钾资源,某工厂用溶浸杂卤石制备硫酸钾,工艺流程如下:
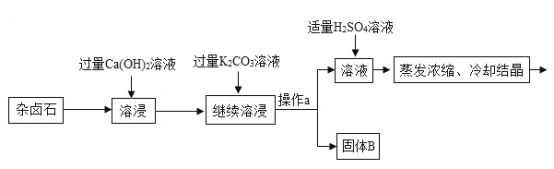
(1)在实验流程中加入过量的Ca(OH)2溶液,目的是出去主要成分中的___;发生反应的化学方程式是___。
(2)操作a的名称是___。
(3)请写出固体B的两种主要成分___、___(用化学式表示)
(4)在使用Ca(OH)2溶液和K2CO3溶液对杂卤石进行“溶浸”时,为探究获得较高浸出杂卤石主要成分的浸取率,某实验小组用测得浸取液中K+的质量分数乱来表示浸取率,在相同的时间里,进行了下述实验组:
实验 | 温度/℃ | Ca(OH)2用量/g | K+浸取率/% |
a | 25 | 2.5 | 72.4 |
b | 40 | 2.5 | 86.55 |
c | 40 | 3 | 90.02 |
d | 60 | 3 | 91.98 |
e | 60 | 4 | 91.45 |
①上述实验的数据中,温度与K+浸取率的关系是___。
②上述5组实验中,若要获得最佳的K+浸取率,选择的反应条件是___℃和Ca(OH)2___g。