题目内容
【题目】碳是形成化合物种类最多的元素,含碳物质是中学化学研究的中要内容.
[提出问题]碳的单质和碳的氧化物有哪些化学性质?
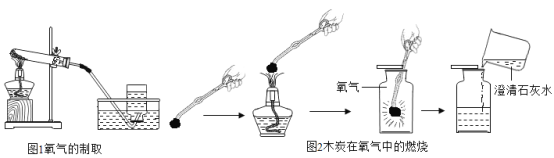
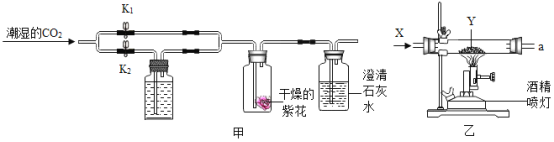
[方案设计]兴趣小组同学设计了图甲、乙所示的实验方案(气体X,固体Y均为纯净物).
[实验探究](1)甲同学:按图甲所示实验,若关闭K1,打开K2,B中紫色小花(用石蕊溶液染成)不变红;若关闭K2,打开K1,紫色小花变红,C中澄清石灰水变浑浊.反应的化学方程式为:B中_____、C中_____.
(2)乙同学:按图乙所示实验,X是CO,Y是CuO粉末,经检验a处的气体是CO2和CO的混合气体,玻璃管中的现象是_____,反应的化学方程式是为_____.该实验a处产生的是CO2和CO混合气体,其原因是_____.
(3)丙同学:按如图乙所示进行实验后,经检验a处的气体中也有CO2和CO.则X和Y的组合还可能有_____.
[实验结论]由上述实验:
(4)二氧化碳的化学性质有_____.
(5)一氧化碳的化学性质有_____.
[实验反思](6)为达到实验目的,A中的药品应该具有的性质是_____.
【答案】CO2+H2O=H2CO3 CO2+Ca(OH)2=CaCO3↓+H2O 黑色固体表面逐渐变为红色 CO+CuO![]() Cu+CO2 一氧化碳还原氧化铜生成二氧化碳气体,部分一氧化碳气体没有参加反应,直接从a口排出 一氧化碳和氧化铁(合理均可) 能和水反应,能使澄清的石灰水变浑浊 还原性 吸收水或二氧化碳
Cu+CO2 一氧化碳还原氧化铜生成二氧化碳气体,部分一氧化碳气体没有参加反应,直接从a口排出 一氧化碳和氧化铁(合理均可) 能和水反应,能使澄清的石灰水变浑浊 还原性 吸收水或二氧化碳
【解析】
[实验探究](1)甲同学:按图甲所示实验,若关闭K1,打开K2,B中紫色小花(用石蕊溶液染成)不变红,干燥的二氧化碳气体不能使紫色小花变红;若关闭K2,打开K1,紫色小花变红,C中澄清石灰水变浑浊.反应的化学方程式为:B中二氧化碳与水反应生成碳酸:CO2+H2O=H2CO3;C中二氧化碳与澄清的石灰水反应,生成碳酸钙和水:CO2+Ca(OH)2=CaCO3↓+H2O;
(2)乙同学:按图乙所示实验,X是CO,Y是CuO粉末,经检验a处的气体是CO2和CO的混合气体,玻璃管中的现象是:黑色固体表面逐渐变为红色,反应的化学方程式是为:CO+CuO![]() Cu+CO2;该实验a处产生的是CO2和CO混合气体,其原因是:一氧化碳还原氧化铜生成二氧化碳气体,部分一氧化碳气体没有参加反应,直接从a口排出;
Cu+CO2;该实验a处产生的是CO2和CO混合气体,其原因是:一氧化碳还原氧化铜生成二氧化碳气体,部分一氧化碳气体没有参加反应,直接从a口排出;
(3)丙同学:按如图乙所示进行实验后,经检验a处的气体中也有CO2和CO.则X和Y的组合还可能有:一氧化碳和氧化铁(合理均可);
实验结论:由上述实验:
(4)二氧化碳的化学性质有:能和水反应,能使澄清的石灰水变浑浊;
(5)一氧化碳的化学性质有:还原性;
实验反思:(6)为达到实验目的,,A中的药品应该具有的性质是吸收水或二氧化碳。

【题目】归纳、整理是学习化学的有效方法。下列选项正确的是
A.认识化学式 “珍惜生命,远离毒品” 某毒品化学式为C12H19O2N,该物质由四种元素组成;该物质由33个原子构成 | B.性质决定用途 石墨具有良好的导电性——可作电极,氧气具有助燃性——可作燃料 |
C.理解化学方程式 2H2O | D.化学与能源 化石燃料属于不可再生能源; 太阳能、风能、氢能属于清洁能源 |
A. AB. BC. CD. D
【题目】我国约在南北朝时就开始冶炼黄铜,黄铜是铜和锌的合金(Cu-Zn),它可以用来制造电器零件及日用品。小华利用一瓶稀盐酸和相关的仪器,测定黄铜样品的组成(不考虑铜中的其它杂质)。将30ml稀盐酸分别加入到10g黄铜粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
第一次 | 第二次 | 第三次 | |
连续加入盐酸的体积/mL | 10 | 10 | 10 |
生成氢气的质量/g | 0.08 | 0.08 | 0.04 |
(1)从上表数据分析,小华用10g合金粉末共收集到氢气 g;
(2)求该合金中铜的质量分数。