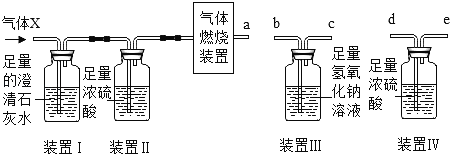
��Ŀ����
����Ŀ��ij��ѧ��ȤС���ͬѧ����ʵ��̨����һƿ��ǩ��ȱ���Լ�����ͼ����ͬѧ�ǶԴ˽���������̽����

��������⣩����һƿʲô��Һ��
����������裩
С��ͬѧ�IJ�����Na2SO3��Һ��С��ͬѧ�IJ�����Na2SO4��Һ����IJ�����_____��Һ����һ�ּ��ɣ���
���������ϣ�
��BaSO3һ�ֲ�����ˮ�İ�ɫ������������ϡ���ᣬ����ϡ���ᷢ����Ӧ��
���������ǿ�����ԣ��ܽ�BaSO3������BaSO4
��Na2SO3��ϡ���ᷴӦ����SO2��SO2��ʹ����ʯ��ˮ����ǣ�Ҳ��ʹƷ����Һ��ɫ��
������ʵ�飩
��1��С��ͬѧȡ�����ĸ���Һ���Թ��У��μ�ϡ���ᣬ������ɫ���壬����Ϊ�Լ��IJ����������С��ͬѧ��Ϊ���Ľ��۲�������ԭ����_____��
��2��С��ͬѧΪ����֤�Լ��IJ��룬��������ʵ�飺
ȡ�����ĸ���Һ���Թ��У��ȵμ�������BaCl2��Һ���ٵμӹ������ᣬ����Ϊ_____��С��ͬѧ��Ϊ�Լ��IJ��������
��3��С��ͬѧ��С��ͬѧ�Ľ���Ҳ��������ɣ�����Ϊ�μ�BaCl2��Һ��ϡ���ᣬNa2SO3Ҳ�����ͬ��������Ϊ��֤���Լ��Ĺ۵㣬��������ʵ�飺
���� | ���� | ʵ������ | ʵ����� |
����1 | ȡ��������Һ���Թ��У��μ�������BaCl2��Һ | _____ | �� |
����2 | ����1���Թ��еμ�������ϡ���� | _____ | ����Һ����Na2SO4 |
����3 | ������2�в���������ͨ��Ʒ����Һ�� | Ʒ����Һ��ɫ | _____ |
д��С��ͬѧʵ������еĻ�ѧ����ʽ_____��_____��
���𰸡�Na2CO3 ��ϡ���ᷴӦ������ɫ����IJ���ֻ��Na2SO3����������Na2CO3 �Ȳ�����ɫ����������ϡ����������ܽ� ������ɫ���� ��ɫ�����ܽ⣬�����ݲ��� ����Һ��Na2SO3 BaCl2+ Na2SO3�TBaSO3��+2NaCl BaSO3+2HCl�TBaCl2+SO2��+H2O
��������
��������裺
��ǩ����Ԫ�ط��ŵĽDZ���2�����ݻ�������Ԫ�ػ��ϼ۴�����Ϊ�㣬�ʻ��п�����̼������Һ��
����ʵ�飺
��1��ȡ�����ĸ���Һ���Թ��У��μ�ϡ���ᣬ������ɫ���壬�������������ƺ����ᷴӦ���ɶ�����������Ҳ������̼���������ᷴӦ����������̼���壻
��2��С��ͬѧ�IJ�����Na2SO4��Һ����������ȷ���������������Ȼ�����Ӧ�������ᱵ�������ó���������ϡ���ᣬ������Ϊ���Ȳ�����ɫ����������ϡ����������ܽ⣻
��3�����ݱ������ṩ����Ϣ���Կ���������������ͨ��Ʒ����Һ����Һ��ɫ��˵�������˶�����������Һ�м����Ȼ������Ȼ������������Ʒ�Ӧ���������ᱵ�������Ȼ��ƣ���ѧ����ʽΪ��BaCl2+ Na2SO3�TBaSO3��+2NaCl������Ϊ������ɫ�����������ᱵ���������ᷴӦ�����Ȼ�����ˮ�Ͷ�������ѧ����ʽΪ��BaSO3+2HCl�TBaCl2+SO2��+H2O������Ϊ����ɫ�����ܽ⣬�����ݲ������ʴ���Һ��Na2SO3��