题目内容
某地新建一化工厂有一种产品属于“复盐”[查阅资料获知:“复盐”是指由两种阳离子和一种酸根离子组成的盐.如光卤石(KCl?MgCl2?6H2O)],该产品可用作铁树、棕榈等花木的肥料.某化学兴趣小组探究该产品的组成,进行了如图实验:.试回答下列问题: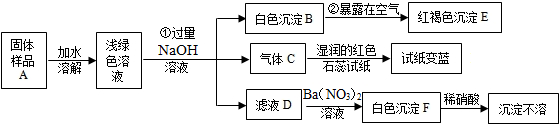
(1)写出下列物质的化学式:
C: ;E: ; F: .
(2)写出下列变化的化学方程式:
②B→E: ;
③D→F: .
(3)上述探究结果说明样品A中含有的离子有 .

(1)写出下列物质的化学式:
C:
(2)写出下列变化的化学方程式:
②B→E:
③D→F:
(3)上述探究结果说明样品A中含有的离子有
考点:物质的鉴别、推断,常见离子的检验方法及现象,化学式的书写及意义,书写化学方程式、文字表达式、电离方程式
专题:框图型推断题
分析:根据该产品溶于水得到浅绿色溶液,所以含有亚铁离子,加入过量的氢氧化钠溶液后,得到白色沉淀B和气体C,B与氧气反应生成氢氧化铁红褐色沉淀,所以B是氢氧化亚铁,E是氢氧化铁,氨气能使湿润的红色石蕊试纸变蓝色,所以C是氨气,滤液D加入硝酸钡溶液,生成的白色沉淀不溶于稀硝酸,所以白色沉淀F是硫酸钡,所以滤液D中有硫酸钠,氢氧化亚铁与氧气与水反应生成氢氧化铁,硫酸钠和硝酸钡反应生成硫酸钡白色沉淀和硝酸钠,配平即可;上述探究结果说明样品A中含有的离子有:亚铁离子、铵根离子、硫酸根离子.
解答:解:(1)该产品溶于水得到浅绿色溶液,所以含有亚铁离子,加入过量的氢氧化钠溶液后,得到白色沉淀B和气体C,B与氧气反应生成氢氧化铁红褐色沉淀,所以B是氢氧化亚铁,E是氢氧化铁,氨气能使湿润的红色石蕊试纸变蓝色,所以C是氨气,滤液D加入硝酸钡溶液,生成的白色沉淀不溶于稀硝酸,所以白色沉淀F是硫酸钡,所以C是NH3,E是Fe(OH)3,F是BaSO4;
(2)②B→E的反应是氢氧化亚铁与氧气、水反应生成氢氧化铁,化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,
③D→F的反应是硫酸钠和硝酸钡反应生成硫酸钡白色沉淀和硝酸钠,化学方程式为:Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3;
(3)通过分析,说明样品A中含有的离子有:亚铁离子、铵根离子、硫酸根离子,化学式为:Fe2+、NH4+、SO42-.
故答案为:(1)NH3,Fe(OH)3,BaSO4;
(2)4Fe(OH)2+O2+2H2O═4Fe(OH)3,Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3;
(3)Fe2+、NH4+、SO42-.
(2)②B→E的反应是氢氧化亚铁与氧气、水反应生成氢氧化铁,化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,
③D→F的反应是硫酸钠和硝酸钡反应生成硫酸钡白色沉淀和硝酸钠,化学方程式为:Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3;
(3)通过分析,说明样品A中含有的离子有:亚铁离子、铵根离子、硫酸根离子,化学式为:Fe2+、NH4+、SO42-.
故答案为:(1)NH3,Fe(OH)3,BaSO4;
(2)4Fe(OH)2+O2+2H2O═4Fe(OH)3,Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3;
(3)Fe2+、NH4+、SO42-.
点评:在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

练习册系列答案
相关题目
固体废弃物是一种环境污染物,对它的处理最合理的方法是( )
| A、利用废弃凹地填埋 |
| B、扔进公海中 |
| C、扔到深山老林中 |
| D、分类回收并进行无公害处理 |
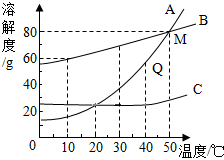 如图是A、B、C三种物质的溶解度曲线.据图,回答下列问题.
如图是A、B、C三种物质的溶解度曲线.据图,回答下列问题.