题目内容
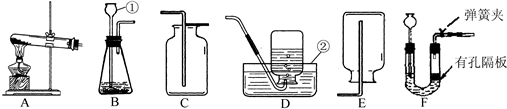
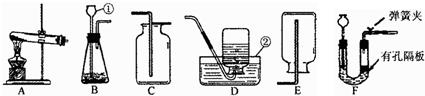
请根据下列装置,回答问题:
(1)写出标号仪器的名称:①______,②______.(2)实验室用装置A制取O2,反应的化学方程式为______;收集装置为______.(3)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应),通过以下四步实验操作可回收二氧化锰.正确操作的先后顺序是______(填写选项序号).?a.烘干 b.溶解 c.过滤 d.洗涤 e.蒸发
(4)装置F与装置B相比,优点是______.
(5)实验室可选取锌与浓硫酸反应制取SO2,(其化学方程式为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O),应该选择的发生装置是______(填序号);老师提醒同学,用此法制取SO2要控制时间否则还可能生成另一种气体.同学们都很好奇,这是什么气体呢?请你根据锌的化学性质,推断此气体可能是______,其理由是______.
解:(1)仪器①为长颈漏斗,仪器②为水槽;
(2)实验室用氯酸钾和二氧化锰的混合物制取O2的反应原理是:氯酸钾在二氧化锰作催化剂和加热的条件下分解生成氯化钾和氧气,故方程式为2KClO3 2KCl+3O2↑;氧气的密度比空气大,不易溶于水,因此收集氧气应选
2KCl+3O2↑;氧气的密度比空气大,不易溶于水,因此收集氧气应选
C或D;
(3)氯化钾溶于水,二氧化锰不溶于水,因此可以用溶解、过滤、洗涤、干燥的方法得到二氧化锰;
(4)比较FB两种装置的使用过程,可发现F装置能控制反应的开始和停止,但B装置不能;
(5)从题中信息“实验室可选取锌与浓硫酸反应制取SO2,(其化学方程式为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O)”可知反应物锌是固体,浓硫酸是液体,不需要加热,因此选当B或F;锌与浓硫酸反应时,随着浓硫酸的不断消耗,浓硫酸逐渐变成稀硫酸,锌能与稀硫酸反应生成氢气.
故答案为:
(1)①长颈漏斗 ②水槽
(2)2KClO3 2KCl+3O2↑; C或D;
2KCl+3O2↑; C或D;
(3)bcda;
(4)可随时控制反应的进行与停止
(5)B或F;H2;反应一段时间后,浓硫酸变为稀硫酸,稀硫酸与锌发生置换反应生成氢气
分析:(1)根据装置中所指定仪器的图示,写出该仪器的名称;
(2)根据实验室用氯酸钾和二氧化锰的混合物制取O2的反应原理书写;根据氧气的物理性质选项收集装置;
(3)根据氯化钾溶于水,二氧化锰不溶于水,因此可以用溶解、过滤、洗涤、干燥的方法得到二氧化锰分析;
(4)比较FB两种装置的使用过程,看开始和停止反应的具体操作;
(5)根据反应物的状态和反应条件结合信息“实验室可选取锌与浓硫酸反应制取SO2,(其化学方程式为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O)”进行分析;根据金属与酸反应的性质进行分析,浓硫酸具有强氧化性,能与金属反应生成硫的氧化物,而稀硫酸能与金属反应生成氢气.
点评:本考点主要考查氢气和氧气的制取装置和收集装置的选择,同时也考查了混合物的分离方法和化学方程式的书写等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.过滤、蒸发、蒸馏是混合物分离的主要方法.
(2)实验室用氯酸钾和二氧化锰的混合物制取O2的反应原理是:氯酸钾在二氧化锰作催化剂和加热的条件下分解生成氯化钾和氧气,故方程式为2KClO3
 2KCl+3O2↑;氧气的密度比空气大,不易溶于水,因此收集氧气应选
2KCl+3O2↑;氧气的密度比空气大,不易溶于水,因此收集氧气应选C或D;
(3)氯化钾溶于水,二氧化锰不溶于水,因此可以用溶解、过滤、洗涤、干燥的方法得到二氧化锰;
(4)比较FB两种装置的使用过程,可发现F装置能控制反应的开始和停止,但B装置不能;
(5)从题中信息“实验室可选取锌与浓硫酸反应制取SO2,(其化学方程式为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O)”可知反应物锌是固体,浓硫酸是液体,不需要加热,因此选当B或F;锌与浓硫酸反应时,随着浓硫酸的不断消耗,浓硫酸逐渐变成稀硫酸,锌能与稀硫酸反应生成氢气.
故答案为:
(1)①长颈漏斗 ②水槽
(2)2KClO3
 2KCl+3O2↑; C或D;
2KCl+3O2↑; C或D;(3)bcda;
(4)可随时控制反应的进行与停止
(5)B或F;H2;反应一段时间后,浓硫酸变为稀硫酸,稀硫酸与锌发生置换反应生成氢气
分析:(1)根据装置中所指定仪器的图示,写出该仪器的名称;
(2)根据实验室用氯酸钾和二氧化锰的混合物制取O2的反应原理书写;根据氧气的物理性质选项收集装置;
(3)根据氯化钾溶于水,二氧化锰不溶于水,因此可以用溶解、过滤、洗涤、干燥的方法得到二氧化锰分析;
(4)比较FB两种装置的使用过程,看开始和停止反应的具体操作;
(5)根据反应物的状态和反应条件结合信息“实验室可选取锌与浓硫酸反应制取SO2,(其化学方程式为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O)”进行分析;根据金属与酸反应的性质进行分析,浓硫酸具有强氧化性,能与金属反应生成硫的氧化物,而稀硫酸能与金属反应生成氢气.
点评:本考点主要考查氢气和氧气的制取装置和收集装置的选择,同时也考查了混合物的分离方法和化学方程式的书写等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.过滤、蒸发、蒸馏是混合物分离的主要方法.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目