��Ŀ����
����Ŀ���������һ��һ������֮�佨����ϵ���ǻ�ѧ���е�˼ά��ʽ��
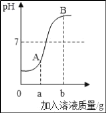
��1����ͼ���������ӽṹʾ��ͼ��
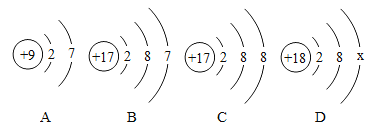
��D�е�x=____��C���ӵķ���Ϊ____��
��A��B��C��D������ͬ��Ԫ�ص�������__��__(�����)������ͬһ���ڵ�Ԫ��������____��
��A��B�������ӵ�____��ͬ���������Ǿ������ƵĻ�ѧ���ʡ�
��2��ij��ѧ��Ӧ����ʾ��ͼ������ʾ����ͼ�ش����⣺
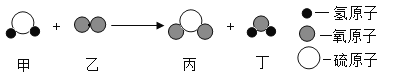
��һ����������_______________��_______________���ɣ�
�ڼ���������Ԫ�صĻ��ϼ�Ϊ_________��
��д�������Ӧ�Ļ�ѧ����ʽ��_______________________��
���𰸡�8 Cl- B C �Ⱥ�� ���������� һ����ԭ�� ������ԭ�� -2 2H2S+3O2=2SO2+2H2O
��������
��1������ԭ�ӵ����������ں���������ɵ�18=2+8+x�����x=8������������Ԫ�ص����࣬C��������Ϊ17���������ֵ���ԭ��������Ԫ�����ڱ�������Ϊ17��Ԫ�����ȣ�����Cl��
���8��Cl��
��ͬ��Ԫ�ص���������ͬ��B��C������������17������ͬ��Ԫ�أ�Ԫ�����ڱ��к��Ž����ڣ����Ž��壬A�Ƿ�������Ԫ�����ڱ��ĵڶ����ڣ�B��C���ȣ����ڵ������ڣ�D��벣�Ҳ���ڵ������ڡ�
���B��C���Ⱥ�벡�
����������������Ԫ�صĻ�ѧ���ʣ�A��B��������������ͬ������7���������Ǿ������ƵĻ�ѧ���ʡ�
���������������
��2���ٸ���ͼʾ���Կ�����һ���������к���������ԭ�Ӻ�һ����ԭ�ӡ�
���һ����ԭ�ӣ�������ԭ�ӡ�
�ڸ���ͼʾ���Կ�����һ�������к���������ԭ�Ӻ�һ����ԭ�ӣ��Ļ�ѧʽΪH2S����Ԫ�صĻ��ϼ�Ϊ+1�����ݻ�����Ļ��ϼ۴�����Ϊ����Եó���Ԫ�صĻ��ϼ�Ϊ-2��
���-2��
�۸���ͼʾ���Կ������ס��ҡ��������Ļ�ѧʽ�ֱ�ΪH2S��O2��SO2��H2O����д����ѧ����ʽH2S+O2��SO2+H2O���ٽ�����ƽ���ɡ�
���2H2S+3O2=2SO2+2H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����ѧ��ȤС��̽������������ʱ����һ��ȥ������Ĥ��þ��������һ������ϡ�����У������ݲ�������ַ�Ӧ���ã������Թ����лҰ�ɫ������д���������ݵķ�Ӧ��ѧ����ʽ______��
��������⣩�Ұ�ɫ������ʲô���ʣ�
��������裩��С����Ϊ�Ұ�ɫ����Ϊ̼��þ��MgCO3��������ͬѧ��Ϊ����Ҫʵ����ܷ�С���IJ��룬������_____________________��
��С����Ϊ���ڷ�Ӧ���Ȼ�þ��������ƫ�࣬�Ұ�ɫ����Ϊ�������ܽ���Ȼ�þ���塣
��Сͮ��Ϊ�Ұ�ɫ����Ϊ__________________��
��ʵ��̽��1��
ʵ����� | ���� | ���� |
��ȡ�Թ��е��ϲ���Һ�������������Ȼ�þ���� | �Ȼ�þ����__��ѡ�����ܽ����������ܽ����� | С�������� |
��ȡ������ɫ������������ϡ������ | û������ð�� | Сͮ������� |
��������̽���������ԭ�в������˷�
���������ϣ�
HCl+AgNO3�THNO3+AgCl����AgCl��һ�ְ�ɫ�������Ȼ������������壬��ʹ��ɫʯ����ֽ��졣����
��ʵ��̽��2��
��������ȡ�Ұ�ɫ���������Թ��м��ȣ���պ����������Һ�IJ����������Թ��ڣ��������ϵ���Һ���ְ�ɫ���ǣ�֤��������__���塣��μ�����������_______��ʵ�鲽�衢�����ۣ���
ͬѧ�������ʦ���֪��������þ��ϡ���ᷴӦʱ����Һ�ᾭ�������Ե������Ҽ�������ǿ�Ĺ��̣��Ӷ������˼�ʽ�Ȼ�þ�������������ܣ���ʽ�Ȼ�þ���ڶ�����ɽṹ����ѧͨʽ�ɱ�ʾΪMgx��OH��yClzmH2O������2x��y��z=0��0��m��6����
����˼��չ��
��1����þ��ϡ���ᷴӦ��ʵ��ʱ��Ϊ�˲����Թ��г��ֻҰ�ɫ������þ��������_______��
��2����Ƭ��ͭƬ����ϡ�����в���������Ҳ����ͬ���ݴ��Ʋ�����Ļ�Ա�ͭ_____��