题目内容
(1)根据实验提供的下列药品和仪器回答有关问题
药品:石灰石、熟石灰、二氧化锰、氯酸钾、过氧化氢溶液、稀盐酸、稀硫酸.
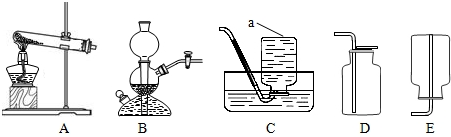
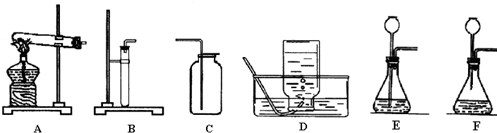
仪器如图1:
①选择适当的药品制一瓶氧气,请写出发生反应的化学方程式,并根据此反应组装一套实验装置(写出标号即可).
②选择适当的药品取一瓶二氧化碳,请写出发生反应的化学方程式.
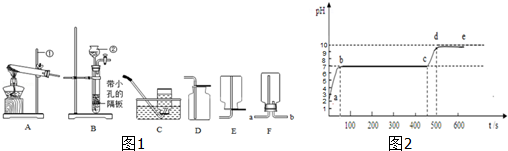
③用制得二氧化碳做如图2所示的兴趣实验时,当滴入氢氧化钠溶液后,可观察到什么现象?请解释原因.
(2)化学反应的快慢、反应现象,生成物质等与反应物的量,反应物的浓度、温度、催化剂等有密切的关系.
①反应物浓度不同,反应现象可能不同,请举一例说明______
②碳在氧气中燃烧,氧气充足生成二氧化碳,氧气不足生成一氧化碳,对比可得到的结论是______
③过氧化氢溶液在常温下能缓慢分解,若加入少量的MnO2时分解加速,说明______
(3)73g溶质质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全反应,试计算反应后所得溶液中溶质的质量分数.
药品:石灰石、熟石灰、二氧化锰、氯酸钾、过氧化氢溶液、稀盐酸、稀硫酸.
仪器如图1:

①选择适当的药品制一瓶氧气,请写出发生反应的化学方程式,并根据此反应组装一套实验装置(写出标号即可).
②选择适当的药品取一瓶二氧化碳,请写出发生反应的化学方程式.
③用制得二氧化碳做如图2所示的兴趣实验时,当滴入氢氧化钠溶液后,可观察到什么现象?请解释原因.
(2)化学反应的快慢、反应现象,生成物质等与反应物的量,反应物的浓度、温度、催化剂等有密切的关系.
①反应物浓度不同,反应现象可能不同,请举一例说明______
②碳在氧气中燃烧,氧气充足生成二氧化碳,氧气不足生成一氧化碳,对比可得到的结论是______
③过氧化氢溶液在常温下能缓慢分解,若加入少量的MnO2时分解加速,说明______
(3)73g溶质质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全反应,试计算反应后所得溶液中溶质的质量分数.
(1)制取装置包括加热和不需加热两种,如果用双氧水制氧气就不需要加热,如果用氯酸钾制氧气就需要加热;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;用氯酸钾制氧气用到的仪器有:试管、集气瓶、铁架台、带弹孔塞的导管、水槽、酒精灯等;碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,配平即可;气球变大是因为二氧化碳与氢氧化钠溶液反应,瓶内压强减小,内外产生压强差的缘故;故答案为:①2KClO3
2KCl+3O2↑;bcdgmn(其它合理即可);②CaCO3+2HCl=CaCl2+H2O+CO2↑;③气球变大
(2)反应物浓度不同,反应现象可能不同,如蜡烛在空气中和氧气中燃烧的现象不同;碳在氧气中燃烧,氧气充足生成二氧化碳,氧气不足生成一氧化碳,对比可得到的结论是:氧气含量的不同决定了生成物不同;过氧化氢溶液在常温下能缓慢分解,若加入少量的MnO2时分解加速,说明MnO2加快了过氧化氢的分解速率;故答案为:①蜡烛在空气中和氧气中燃烧的现象不同;②氧气含量的不同决定了生成物不同;③MnO2加快了过氧化氢的分解速率;
(3)设反应后所得溶液中氯化钠的质量为x
HCl+NaOH=NaCl+H2O
36.558.5
73g×20% x
=
x=23.4g
反应后所得溶液中溶质的质量分数=
×100%=11.7%
答:反应后所得溶液中溶质的质量分数是11.7%
故答案为:11.7%
| ||
| △ |
(2)反应物浓度不同,反应现象可能不同,如蜡烛在空气中和氧气中燃烧的现象不同;碳在氧气中燃烧,氧气充足生成二氧化碳,氧气不足生成一氧化碳,对比可得到的结论是:氧气含量的不同决定了生成物不同;过氧化氢溶液在常温下能缓慢分解,若加入少量的MnO2时分解加速,说明MnO2加快了过氧化氢的分解速率;故答案为:①蜡烛在空气中和氧气中燃烧的现象不同;②氧气含量的不同决定了生成物不同;③MnO2加快了过氧化氢的分解速率;
(3)设反应后所得溶液中氯化钠的质量为x
HCl+NaOH=NaCl+H2O
36.558.5
73g×20% x
| 36.5 |
| 73g×20% |
| 58.5 |
| x |
反应后所得溶液中溶质的质量分数=
| 23.4g |
| 73g+127g |
答:反应后所得溶液中溶质的质量分数是11.7%
故答案为:11.7%

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目