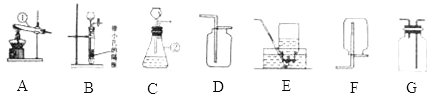题目内容
【题目】生活中常见物质的性质、制法等是化学研究的重要内容。
(1)复分解反应发生后,生成物肯定不会是_________(填“单质”或“化合物”)。
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。下列说法正确的是____________
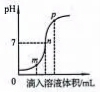
a. m点所示溶液为碱性
b. n点所示溶液中加紫色石蕊溶液显红色
c. p点所示溶液中溶质为NaCl和NaOH
d. 该图所对应操作是将盐酸滴入氢氧化钠溶液中
(3)浓硫酸和浓盐酸敞口放置均会变稀,这是为什么?
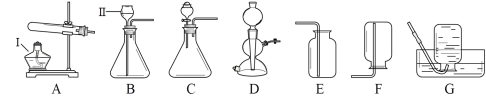
(4)下图装置可做一氧化碳还原氧化铁的实验,并检验生成的气体产物。
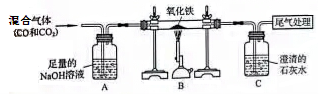
①B装置玻璃管里可观察到的现象是________________。
②C装置中反应的化学方程式为___________________;
③实验结束后,若要确定A装置的溶液中溶质的成分,请设计合理的实验方案,简要写出实验步骤、现象和结论。(提示:Na2CO3溶液呈碱性)
(5)工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将某些金属从其氧化物中置换出来。若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?
【答案】(1)单质(2)c (3)浓硫酸有吸水性,溶剂量增加,溶液变稀;浓盐酸有挥发性,溶质的量减少,溶液变稀。 (4)①红色固体变黑色 ②Ca(OH)2 +CO2 = CaCO3↓+H2O ③取少量A装置中的溶液,加入足量的BaCl2溶液,若有白色沉淀生成,则溶质中含有Na2CO3;静置,向上层清液中滴加无色酚酞溶液,若溶液变红色,则溶质中还含有NaOH。(5) 10.8kg.
【解析】
试题分析:(1)复分解反应发生后,生成物肯定不会是单质,因为复分解反应是化合物交换成分得到两种化合物;(2)根据图示可知,是往盐酸中滴加氢氧化钠溶液,故m点所示溶液为酸性;n点是溶液显中性所示溶液中加紫色石蕊溶液显紫色;p点为氢氧化钠过量的情况,故所示溶液中溶质为NaCl和NaOH 是正确的;(3)浓硫酸有吸水性,溶剂量增加,溶液变稀;浓盐酸有挥发性,溶质的量减少,溶液变稀。(4)①因为一氧化碳与氧化铁反应生成铁粉,故现象为红色固体变黑色 ②C装置中反应的化学方程式为Ca(OH)2 +CO2 = CaCO3↓+H2O ③确定A装置的溶液中溶质的成分的方案为取少量A装置中的溶液,加入足量的BaCl2溶液,若有白色沉淀生成,则溶质中含有Na2CO3;静置,向上层清液中滴加无色酚酞溶液,若溶液变红色,则溶质中还含有NaOH。
(5)设需要消耗铝的质量为x
8Al +3Fe3O4 ![]() 4Al2O3 +9Fe
4Al2O3 +9Fe
216 504
x 25.2kg
216/504=x /25.2kg
解得 x=10.8kg

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案