题目内容
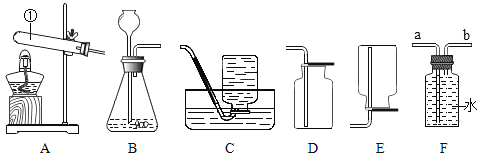
【题目】氧化钙俗名生石灰,某同学针对氧化钙设计了如下实验方案:
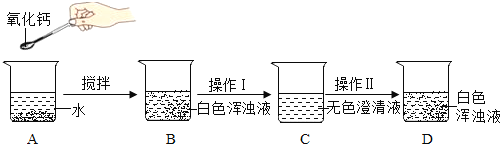
(1)A中发生反应的化学方程式为______________,分离B中难溶物的操作Ⅰ叫____________。
(2)如果要用实验证明C中不是水而是一种溶液,可以选择__________(填序号)进行实验。
①稀盐酸 ②酚酞溶液 ③CO2 ④NaCl溶液
(3)操作Ⅱ是加入NaOH固体后无色澄清液出现白色固体(NaOH固体全部溶解),则白色固体的化学式是_____________。
【答案】![]() 过滤 ②③ Ca(OH)2
过滤 ②③ Ca(OH)2
【解析】
(1)氧化钙与水反应生成氢氧化钙,所以化学方程式为![]() ;分离固、液混合物的操作一般为过滤;
;分离固、液混合物的操作一般为过滤;
(2)C为氢氧化钙溶液,据此分析与各物质反应的现象,判断是否为氢氧化钙溶液:
①盐酸与氢氧化钙反应生成氯化钙和水,无明显现象,无法判断C为溶液还是水,①不符合题意;
②氢氧化钙为碱性溶液,加入酚酞后,溶液变为红色,可以判断C为溶液,不是水,②符合题意;
③二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,可以观察沉淀现象,判断C为溶液,不是水,③符合题意;
④氯化钠溶液与氢氧化钙不反应,没有明显现象,无法判断C为溶液还是水,④不符合题意;故选②③;
(3)氢氧化钠溶于水,属于放热反应,氢氧化钙的溶解度随温度升高而降低,所以氢氧化钙析出,变为白色固体,所以白色固体化学式为Ca(OH)2。

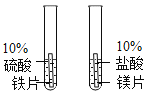
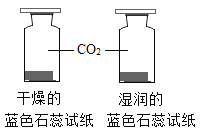
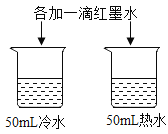
【题目】控制变量是实验探究的重要方法。下列实验设计不能达到实验目的的是( )
|
|
|
|
A.探究铁、镁金属活动性强弱 | B.探究二氧化碳与水是否发生反应 | C.探究不同溶剂中物质溶解性大小 | D.探究温度对分子运动快慢的影响 |
A. AB. BC. CD. D
【题目】如图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
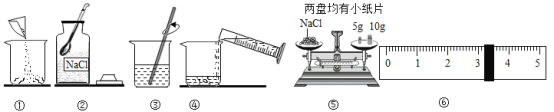
(1)用图中表示的序号表示配制溶液的正确操作顺序______.
(2)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见图⑥,则称取的NaCl质量为______.
(3)称量NaCl质量完毕放回砝码时,发现有一个砝码缺损了一个小角,若其他操作步骤正确,则所配溶液的溶质质量分数______(填“大于”、“小于”或“等于”)10%.
(4)除去下列各物质中的少量杂质所选用的试剂及操作方法均正确的是_____(多选题,选对一个得一分,错选不得分).
物质 | 杂质(少量) | 试剂 | 操作方法 | |
A | 氯化钙固体 | 熟石灰 | 过量稀盐酸 | 蒸发结晶 |
B | H2 | HCl | 适量的饱和碳酸氢钠溶液 | 洗气 |
C | 硝酸 | 盐酸 | 过量的硝酸银溶液 | 过滤 |
D | FeSO4溶液 | CuSO4溶液 | 过量的Fe | 过滤 |