题目内容
【题目】(10分)通过实验对草酸(相对分子质量是90)进行如下研究。
【查阅资料】①浓硫酸常作干燥剂 ②浓NaOH溶液常用于吸收CO2气体
③无水硫酸铜吸水后由白色变为蓝色 ④氯化钯(PdCl2)溶液遇CO产生黑色沉淀
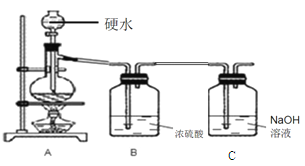
【实验准备】选用下列实验装置(气密性良好,部分固定装置已略去):
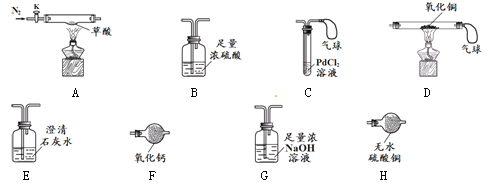
【实验I】检验草酸分解的产物。
实验步骤 | 实验现象 | 实验结论及分析 |
(1)按A→H→E→C 连接仪器 (2)关闭K,点燃A处酒精灯 | H中 E中澄清石灰水变浑浊 C中产生黑色沉淀,气球鼓起 | 草酸分解生成了CO2、CO和H2O ①E中反应的化学方程式是 ②C中气球的作用是 |
【实验II】取9 g草酸进行实验,测定生成物的质量并确定草酸的组成。
实验步骤 | 实验数据 | 实验结论及分析 |
(1)选择A、B、D、G装置组合进行实验 (2)鼓入过量的N2后,分别称量B、D、G的质量 (3)关闭K,点燃A、D处的酒精灯,至草酸完全分解 (4)熄灭A处酒精灯,通入过量的N2,熄灭D处酒精灯,再次分别称量B、D、G的质量 | B装置增重1.8 g D装置中固体 质量减少0.8 g G装置增重4.4 g | ①A、B、D、G装置的正确连接顺序是A→ → →D ②向A中两次通入N2,其中 第二次的目的是 ③草酸的化学式是 ④反思:若用F代替B,则不能测定草酸的组成,其原因是 |
【答案】【实验I】 白色固体变成蓝色
①Ca(OH)2 + CO2 ![]() CaCO3↓+ H2O
CaCO3↓+ H2O
②收集尾气(或尾气处理装置)
【实验II】①B→G
②将生成的气体完全排入吸收装置,使其被完全吸收
③C2H2O4
④CaO可同时吸收H2O、CO2,导致无法准确测量H2O、CO2的质量
【解析】
试题分析:【实验I】根据资料:若草酸分解的产物中含有水,那么H中的无水硫酸铜会变成蓝色;若生成了二氧化碳,那么E中的澄清石灰水会变浑浊;若产生了一氧化碳,那么C中的氯化钯(PdCl2)溶液会变成黑色;由于一氧化碳有毒,直接排放到空气中会污染空气,故要要尾气处理装置,气球可用于收集尾气;
【实验II】①由于草酸分解生成了水、二氧化碳和一氧化碳。由于气体溶液中含有水,故要先把水吸收以免造成实验结果偏大,而水直接利用浓硫酸吸收即可;检验一氧化碳是利用一氧化碳的的还原性呈二氧化碳来判断,那么要先利用氢氧化钠溶液将二氧化碳吸收掉,然后再把气体通入氧化铜中,故顺序是A→B→G→D;
②向A中两次通入N2,其中第二次的目的是将生成的气体完全排入吸收装置,使其被完全吸收;
③B装置增重1.8 g,说明分解生成的水的质量为1.8g,那么氢元素的质量=1.8g×2/18 =0.2g,氧元素的质量为1.6g;G装置增重4.4 g,说明生成的二氧化碳的质量为4.4g,那么碳元素的质量为4.4g×12/44 =1.2g,氧元素的质量为3.2g,;D装置中固体质量减少0.8 g,说明氧化铜中氧元素的质量为0.8g,那么氧化铜是质量=0.8g /(16/80)=4g,利用化学方程式即可计算出一氧化碳的质量1.4g,那么碳元素的质量为1.4g×12/28 =0.6g,那么氧元素的质量为0.8g。综合上述计算,草酸中碳元素的质量=1.2g+0.6g=1.8g,氧元素的质量=1.6g+3.2g+0.8g=5.6g;氢元素的质量=0.2g。依据质量守恒定律化学反应前后物质的总质量不变可知草酸的质量为1.8g+4.4g+1.4g=7.6g,设氢原子的个数为x,那么7.6g× x/90 =0.2g,x=2,设碳原子的个数为y,那么7.6g× 12y/90 =1.8g,y=2,氧原子的个数为z,那么7.6g× z/90 =5.6g,z=4,故草酸的化学式为C2H2O4;
④由于CaO可同时吸收H2O、CO2,导致无法准确测量H2O、CO2的质量,故不能测定出草酸的组成。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】(12分)黄石市华新水泥厂化验室,为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水。)有关实验数据如下表:
反应前 | 反应后 | ||
实验数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
150 g | 12 g | 157.6 g | |
(1)根据质量守恒定律可知,反应中生成二氧化碳的质量为 g。
(2)求该石灰石中碳酸钙的质量分数。