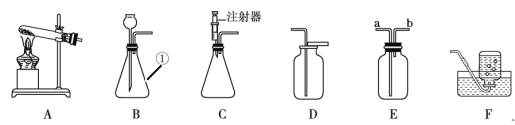
题目内容
【题目】从微观角度认识物质,是学好化学的基础.
(1)构成物质的微粒有分子、原子和________.构成氯化钠的微粒是________(填化学符号).
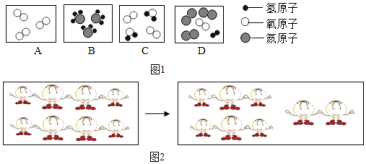
(2)如图![]() 中表示化合物的是_____(填字母序号).用化学用语表示图
中表示化合物的是_____(填字母序号).用化学用语表示图![]() :________,图
:________,图![]() :________,图
:________,图![]() :________.
:________.
(3)在玻璃杯中加入![]() 水,向水中加入一块冰糖,在杯子的外壁沿液面划一条水平线,过一会儿发现糖块消失了,液面比原来水平线降低了,请通过这一现象,推测分子具有的性质:①____;②___.
水,向水中加入一块冰糖,在杯子的外壁沿液面划一条水平线,过一会儿发现糖块消失了,液面比原来水平线降低了,请通过这一现象,推测分子具有的性质:①____;②___.
(4)用“![]() ”表示氢原子,“
”表示氢原子,“![]() ”表示氧原子,若它们构成的分子在一定条件下发生如图
”表示氧原子,若它们构成的分子在一定条件下发生如图![]() 所示的变化.
所示的变化.
①下列关于该反应的说法中,不正确的是_____(填字母序号)
![]() .有氧化物生成
.有氧化物生成
![]() .反应前后各种微粒的数目均煤油改变
.反应前后各种微粒的数目均煤油改变
![]() .原子是化学反应中的最小微粒
.原子是化学反应中的最小微粒
![]() .这是一个分解反应
.这是一个分解反应
②从图中你还能获得的微观信息是_____(答出一点即可).
【答案】离子 Na+和Cl- B O2 NH3 N2、H2、O2 分子总是在不断运动着 分子间是有间隔的 B 在化学变化中,分子可以再分
【解析】
(1)构成物质的微粒主要有分子原子离子,氯化钠有离子构成,主要是氯离子与钠离子
(Na+和Cl-);
(2)A中表示的是一种分子,为单质;B中表示的是一种分子,该分子由两种不同的原子构成,属于化合物;C、D中表示属于混合物,故用化学用语表示图A为O2,图B为NH3,图D为N2、H2、O2;
(3)溶质的溶解反映了物质的微粒性,是分子扩散的结果,体现了微粒的运动性与分子之间的间隔;
(3)①属微观粒子题,从宏观分析为双氧水制取氧气的反应,可以看出反应中分子的种类和个数发生了改变,故选B;
②反应中分子的种类发生了改变,数目也有了相应的变化。

【题目】某小组在做双氧水制氧气的实验时不小心把双氧水洒到了水泥地板上,意外地发现地上立即产生大量的气泡,于是她对这一现象产生了探究兴趣.
(提出问题)除二氧化锰外,水泥块是否也能作双氧水分解的催化剂?它的催化效比二氧化锰的是否更弱?
(设计实验)小雨以相同的收集时间为标准,设计了下列三组实验(其它可能影响实验的因素均忽略).
实验序号 | 双氧水溶液体积 | 其他物质质量 | 收集时间/s |
① | 40gmL | / | 200 |
② | 40gmL | 水泥块 : | 100 |
③ | 40gmL | MnO2 : 0.5g | 67 |
(1)加入水泥块的质量为_____g ;
(2)实验③的文字表达式为________________
(3)为达到实验目的,选择收集氧气的方法是________________.
(4)对比实验②和实验①,得到的结论是________。
(5)为进一步探究水泥块是否可以作为过氧化氢的催化剂,将实验②反应后的固体加水溶解、过滤、洗涤、干燥、称量,这样做的目的是______。再将以上得到的水泥块,____________,说明水泥块是此实验的催化剂。
(评价设计)你认为小雨设汁实验③和实验②对比的目的是_______________ .
【题目】下面是一些关于铁的实验研究,试按要求填空。
一、图1为实验室模拟炼铁的实验改进装置(部分夹持仪器略去)。实验步骤如下:

Ⅰ.连接好装置,并检查装置气密性;
Ⅱ.装好药品,先通一会CO,再点燃酒精灯;
Ⅲ.实验结束,先撤去酒精喷灯,继续通CO直至玻璃管冷却;
回答下列问题:
(1)实验中可看到A处的现象为_________,该反应的化学方程式为________。
(2)步骤Ⅱ中先通一会CO,再点燃酒精喷灯的目的是__________。
(3)盛满石灰水的B装置在此实验中的作用有如下说法:
①收集多余的一氧化碳 ②检验并吸收反应生成的二氧化碳,上述说法中正确的是______。
A. 只有① B. 只有② C. 是①和②
(4)为进一步证明玻璃管中固体有铁生成,按要求设计实验方案。
验证方法 | 实验操作 | 实验现象、结论 |
物理方法 | __________ | __________ |
化学方法 | __________ | __________ |
(5)冶炼480万吨含氧化铁60%的赤铁矿石,理论上能得到含杂质4%的生铁的质量是________。
二、铁锈的探究
用图2所示实验探究铁生锈的条件(每支试管中均放有完全相同的洁净铁钉):
①甲同学认为,试管A发生的现象就能够说明铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果。乙同学不同意他的观点,认为必须全面观察试管__________(选填试管编号)发生的现象,并经过科学严谨的推理,才能得出上述结论。
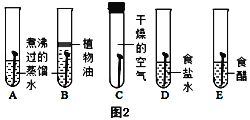
②试管D和E实验的目的是进一步探究铁在_________的环境中是否更容易锈蚀。
③A、B试管中用煮沸过迅速冷却的水,煮沸的目的是_________。
【题目】根据如图回答问题.

(1)仪器![]() 的名称是________.
的名称是________.
(2)实验室用过氧化氢制氧气应选用的发生装置是________(填装置代号),若用![]() 装置收集氧气,验满的方法是________.
装置收集氧气,验满的方法是________.
(3)若用装置![]() 制取氧气,反应的化学方程式为________.若要收集较纯的氧气,需观察到________现象时,再开始收集气体,收集完氧气后,应先________,再熄灭酒精灯,其原因是________.
制取氧气,反应的化学方程式为________.若要收集较纯的氧气,需观察到________现象时,再开始收集气体,收集完氧气后,应先________,再熄灭酒精灯,其原因是________.
(4)若用![]() 装置收集好的氧气,进行铁丝(已打磨光亮)燃烧的实验,请填空:
装置收集好的氧气,进行铁丝(已打磨光亮)燃烧的实验,请填空:
操作步骤 | 实验现象 | 化学方程式 |
把光亮的细铁丝盘成________状,下端系一根火柴,点燃火柴,待________时,插入充满氧气的集气瓶中. | ________ | ________ |
【题目】工业上生产电石(CaC2)并制备重要工业原料乙炔(CxHy)流程如图1:
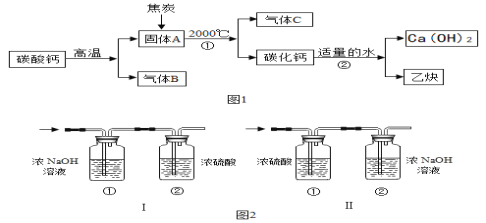
(资料)
(1)CaCO3![]() CaO(固体)+CO2↑。
CaO(固体)+CO2↑。
(2)浓硫酸是常用的干燥剂,NaOH 溶液能吸收CO2。
(讨论)
(1)C、B组成元素相同,C有毒,反应①的化学方程式为_______。
(测定乙炔组成)资料:一个乙炔分子由四个原子构成。
(2)将一定量的乙炔(CxHy)完全燃烧,并将生成的气体缓缓通过图2的_________
(选填“I”或“II”)装置,并再缓缓通入一段时间 的 N2,并记录实验数据于表中。
反应前质量/g | 反应后质量/g | |
装置① | 125.3 | 127.1 |
装置② | 78.2 | 87.0 |
(3)实验中“缓缓通入一段时间 N2”的目的是___________。
(4)计算:乙炔中碳元素的质量为________g,氢元素 的质量为_______g,乙炔的化学式为_________。
(5)反应②的化学方程式___________。