题目内容
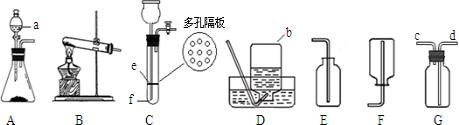
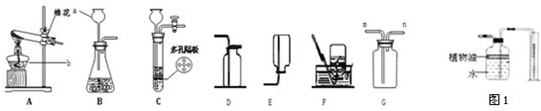
结合图示实验装置,回答下列问题.(1)写出图中标号仪器的名称①
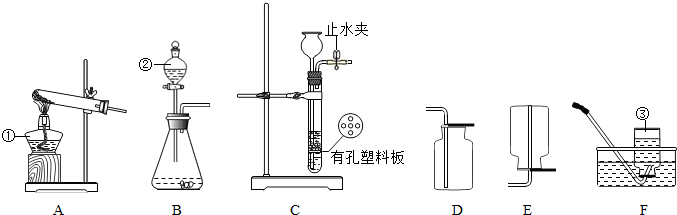
(2)实验室用锌粒和稀硫酸制取氢气的化学方程式为:
若用C装置制取氢气,检查气密性的方法是
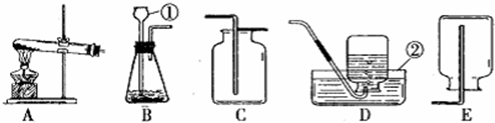
(3)实验室常用加热氢氧化钙固体和氯化铵固体混合物的方法来制取氨气,已知氨气的密度小于空气,易溶于水且能和水反应.则实验室制取氨气的发生装置为
(4)实验室用二氧化锰催化双氧水制取氧气,发生装置为
(5)某化学兴趣小组同学想探究FeCl3溶液是否对过氧化氢的分解具有催化作用.
①请你帮助他们完成实验报告:
| 实验过程 | 实验现象 | 实验结论 |
| 在一支试管中加5%的H202溶液,然后滴人适量的FeCl3溶液,把带火星的木条伸入试管. | FeCl3溶液可以 催化分解H202 |
甲同学:催化分解H202的是FeCl3溶液中的H20;
乙同学:催化分解H202的是FeCl3溶液中的Fe3+;
丙同学:催化分解H202的是FeCl3溶液中的Cl-.
你认为最不可能的是
③同学们对余下的两个猜想,用实验进行了探究.请你仔细分析后填表:
| 实验过程 | 实验现象 | 结论 |
| 向盛有5%的H202溶液的试管中加入少量的盐酸(含有Cl-),并把带火星的木条伸人试管. | 无明显现象 | |
| 向盛有5%的H202溶液的试管中加入少量的Fe2(S04)3溶液(含有Fe3+),并把带火星的木条伸人试管. |
分析:(1)根据实验室常用仪器的名称和选用填空;
(2)根据书写方程式的步骤:写配注等,书写反应方程式;
根据检查气密性的方法和气压 的原理进行分析解答本题;
(3)根据反应装置和反应原理:固体+固体,且需要加热,及氨气的性质进行解答;
(4)二氧化锰催化双氧水制取氧气的反应装置和反应原理,制取氧气使用:固体+液体反应,不需加热;依据氧气的密度大于空气,不易溶于水,性质收集装置;正确书写反应化学方程式;
(5)催化剂是一种物质,在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂,又叫触媒.催化剂在化学反应中所起的作用叫催化作用.
本题为设计实验,①验证起催化作用的“催化分解H202的是FeCl3溶液中的Fe3+”带火星的木条检验生成的气体是否是氧气;②反驳水是催化剂,因为H202溶液中就有水;③验证Cl-不能催化分解H202 .
(2)根据书写方程式的步骤:写配注等,书写反应方程式;
根据检查气密性的方法和气压 的原理进行分析解答本题;
(3)根据反应装置和反应原理:固体+固体,且需要加热,及氨气的性质进行解答;
(4)二氧化锰催化双氧水制取氧气的反应装置和反应原理,制取氧气使用:固体+液体反应,不需加热;依据氧气的密度大于空气,不易溶于水,性质收集装置;正确书写反应化学方程式;
(5)催化剂是一种物质,在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂,又叫触媒.催化剂在化学反应中所起的作用叫催化作用.
本题为设计实验,①验证起催化作用的“催化分解H202的是FeCl3溶液中的Fe3+”带火星的木条检验生成的气体是否是氧气;②反驳水是催化剂,因为H202溶液中就有水;③验证Cl-不能催化分解H202 .
解答:解:(1)根据实验室常用仪器的名称,图中标号仪器的名称①酒精灯;②分液漏斗;③集气瓶;
(2)根据书写方程式的步骤:写配注等,用锌粒和稀硫酸制取氢气的化学方程式为:Zn+H2S04=ZnS04+H2↑;
根据检查气密性的方法:关闭止水夹,向长颈漏斗中加水,形成液封后,继续加水,漏斗中若可形成一段稳定的水柱,则气密性良好;有效地控制反应的发生和停止,应将锌粒放在有孔塑料板的上面;原理是:关闭止水夹时,试管气压增大,将液体压回长颈漏斗,固液分离,反应停止;
(3)根据反应装置和反应原理:固体+固体,且需要加热,及氨气的密度小于空气,易溶于水且能和水反应;所以用加热氢氧化钙固体和氯化铵固体混合物的方法来制取氨气的发生装置为 A,收集装置为 E;
(4)二氧化锰催化双氧水制取氧气的反应装置和反应原理,制取氧气使用:固体+液体反应,不需加热;依据氧气的密度大于空气,不易溶于水,性质收集装置;所以发生装置为 B,收集装置为:D或F;
反应化学方程式为:2H202
2H20+02↑;
(5)②最不可能的是 甲同学的猜想,理由是 因为H202溶液中就有水;
③向H202溶液中加入少量盐酸,无氧气生成,“实验结论”Cl-不能催化分解H202;
加入含有Fe3+的少量的Fe2(SO4)3;则“实验现象”带火星的木条复燃,“实验结论”Fe3+可以催化分解H202.
故答案为:(1)①酒精灯;②分液漏斗;③集气瓶;
(2)Zn+H2S04=ZnS04+H2↑;
关闭止水夹,向长颈漏斗中加水,形成液封后,继续加水,漏斗中若可形成一段稳定的水柱,则气密性良好;
上面;关闭止水夹时,试管气压增大,将液体压回长颈漏斗,固液分离,反应停止;
(3)A;E;
(4)B;D或F;2H202
2H20+02↑;
(5)①试管中有大量的气泡产生,带火星木条复燃;
②甲;H202溶液中本身就含有H20;
③丙同学猜想错误或起催化作用的不是Cl-(或Cl-不能催化分解H2O2);
试管中有大量的气泡产生,带火星的木条复燃;乙同学猜想正确或起催化作用的是Fe3+(Fe3+可以催化分解H202).
(2)根据书写方程式的步骤:写配注等,用锌粒和稀硫酸制取氢气的化学方程式为:Zn+H2S04=ZnS04+H2↑;
根据检查气密性的方法:关闭止水夹,向长颈漏斗中加水,形成液封后,继续加水,漏斗中若可形成一段稳定的水柱,则气密性良好;有效地控制反应的发生和停止,应将锌粒放在有孔塑料板的上面;原理是:关闭止水夹时,试管气压增大,将液体压回长颈漏斗,固液分离,反应停止;
(3)根据反应装置和反应原理:固体+固体,且需要加热,及氨气的密度小于空气,易溶于水且能和水反应;所以用加热氢氧化钙固体和氯化铵固体混合物的方法来制取氨气的发生装置为 A,收集装置为 E;
(4)二氧化锰催化双氧水制取氧气的反应装置和反应原理,制取氧气使用:固体+液体反应,不需加热;依据氧气的密度大于空气,不易溶于水,性质收集装置;所以发生装置为 B,收集装置为:D或F;
反应化学方程式为:2H202
| ||
(5)②最不可能的是 甲同学的猜想,理由是 因为H202溶液中就有水;
③向H202溶液中加入少量盐酸,无氧气生成,“实验结论”Cl-不能催化分解H202;
加入含有Fe3+的少量的Fe2(SO4)3;则“实验现象”带火星的木条复燃,“实验结论”Fe3+可以催化分解H202.
故答案为:(1)①酒精灯;②分液漏斗;③集气瓶;
(2)Zn+H2S04=ZnS04+H2↑;
关闭止水夹,向长颈漏斗中加水,形成液封后,继续加水,漏斗中若可形成一段稳定的水柱,则气密性良好;
上面;关闭止水夹时,试管气压增大,将液体压回长颈漏斗,固液分离,反应停止;
(3)A;E;
(4)B;D或F;2H202
| ||
(5)①试管中有大量的气泡产生,带火星木条复燃;
②甲;H202溶液中本身就含有H20;
③丙同学猜想错误或起催化作用的不是Cl-(或Cl-不能催化分解H2O2);
试管中有大量的气泡产生,带火星的木条复燃;乙同学猜想正确或起催化作用的是Fe3+(Fe3+可以催化分解H202).
点评:掌握检查装置气密性的方法,熟记氢气和氧气的反应原理和制取装置及选取方法,了解控制反应的发生和停止的原理是想法使反应物能分离;了解催化剂只是改变反应的速率,对反应的生成物及生成物的量都没有影响;掌握氧气的检验方法.

练习册系列答案
相关题目