题目内容
下图是有关稀盐酸和氢氧化钠溶液发生化学反应的微观示意图.请回答下列问题:
(1)A中溶液能使紫色石蕊溶液显 色,因为其中含有较多的(填粒子符号) ;B中溶液能使无色酚酞溶液显 色,因为其中含有较多的(填粒子符号) .
(2)将50g 7.3% 的A中的溶液与50g 8% 的B中的溶液混合,得到C中的溶液,其中主要含有的粒子是(填粒子符号) ;C中的溶液中溶质的质量分数是 .
【答案】分析:(1)酸的溶液能使石蕊变红色,是因为含有氢离子,碱的溶液能使酚酞变红是因为氢氧根的缘故.
(2)利用化学方程式的计算,确定反应后的产物并进行分析即可.
解答:解:
(1)酸的溶液能使石蕊变红,是因为含有氢离子的缘故,碱的溶液能使酚酞变红是因为氢氧根离子的缘故.
故答案为:红;H+;红;OH-
(2)氢氧化钠与盐酸反应时的方程式是:NaOH+HCl=NaCl+H2O,两者反应时的质量比是40:36.5,50g 7.3% 的A中的溶液与50g 8% 所含溶质的质量比正好与之相等,也就是两者恰好反应,溶质是氯化钠溶剂是水,所以溶液中的离子主要是氯离子钠离子与水分子.
设生成氯化钠的质量是x
NaOH+HCl=NaCl+H2O
40 58.5
50g×8% x

x=5.85g
所的溶质的质量分数= ×100%=5.85%
×100%=5.85%
故答案为:Na+、Cl-、H2O;5.85%
点评:此题是关于中和反应发生时微观问题的考查题,解题时要能通过宏观的现象找到微观的原因,是一道训练学生思维的好题.
(2)利用化学方程式的计算,确定反应后的产物并进行分析即可.
解答:解:
(1)酸的溶液能使石蕊变红,是因为含有氢离子的缘故,碱的溶液能使酚酞变红是因为氢氧根离子的缘故.
故答案为:红;H+;红;OH-
(2)氢氧化钠与盐酸反应时的方程式是:NaOH+HCl=NaCl+H2O,两者反应时的质量比是40:36.5,50g 7.3% 的A中的溶液与50g 8% 所含溶质的质量比正好与之相等,也就是两者恰好反应,溶质是氯化钠溶剂是水,所以溶液中的离子主要是氯离子钠离子与水分子.
设生成氯化钠的质量是x
NaOH+HCl=NaCl+H2O
40 58.5
50g×8% x

x=5.85g
所的溶质的质量分数=
 ×100%=5.85%
×100%=5.85%故答案为:Na+、Cl-、H2O;5.85%
点评:此题是关于中和反应发生时微观问题的考查题,解题时要能通过宏观的现象找到微观的原因,是一道训练学生思维的好题.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目


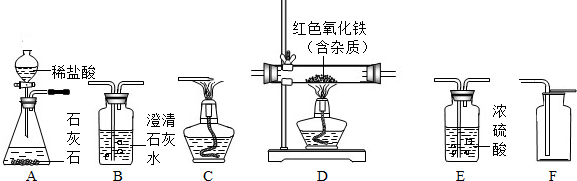
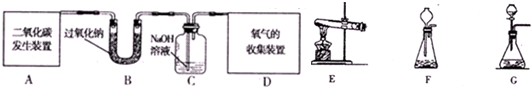

 示的装置收集氢气,则气体应从
示的装置收集氢气,则气体应从
