题目内容
【题目】某实验小组同学对碳酸钠和碳酸氢钠的化学性质进行研究。进行如下两个实验:
(实验一)热稳定性。
对碳酸钠和碳酸氢钠固体分别加热发现,二者热稳定性有明显差异。只有碳酸氢钠会受热分解。请写出发生的化学反应方程式:___。
(实验二)与酸的反应
将等质量、等浓度的碳酸钠和碳酸氢钠溶液分别与相同盐酸反应,发现碳酸氢钠溶液产生气泡的速率明显快于碳酸钠溶液。实验后大家对碳酸钠溶液与盐酸反应后的烧杯中的溶质成分发生了兴趣。
(提出问题)该烧杯内溶液的溶质是什么?
(做出猜想)猜想一:可能是NaCl和HCl:猜想二:可能只有NaCl:猜想三:可能是_____。
(进行实验)实验步骤1:
取少量烧杯内的溶液于试管中,滴入几滴酚酞溶液,振荡,发现_____;结论:猜想三不正确。
实验步骤2:
取少量烧杯内的溶液于试管中,加入少量硝酸银溶液,振荡,产生白色沉淀。结论:溶液中有HCl,猜想二不正确,猜想一正确。
蛋蛋同学认为步骤2不能证明猜想二错误,原因是_____。
根据所学化学知识,你认为可采用下列物质中的_____(填字母)来代替实验步骤2的硝酸银溶液进一步实验,从而验证猜想一和猜想二的正确性。
a.pH试纸 b.铁粉 c.铜粉 d.氧化铜固体
(反思交流)烧杯中溶液未经处理直接倒入下水道,可能造成的危害是_____。
【答案】2NaHCO3![]() Na2CO3+H2O+CO2↑ 可能是NaCl和Na2CO3 溶液不变色 盐酸和氯化钠均能与硝酸银溶液反应生成氯化银白色沉淀 abd 腐蚀下水道
Na2CO3+H2O+CO2↑ 可能是NaCl和Na2CO3 溶液不变色 盐酸和氯化钠均能与硝酸银溶液反应生成氯化银白色沉淀 abd 腐蚀下水道
【解析】
[实验一]碳酸氢钠在加热的条件下分解为碳酸钠、水和二氧化碳;故填:2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
[实验二][做出猜想]碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,若二者恰好反应,则反应后的溶液中只含氯化钠;若反应后盐酸有剩余,则反应后的溶液中含有氯化钠和氯化氢;若反应后碳酸钠有剩余,则反应后的溶液中含有氯化钠和碳酸钠;故填:可能是NaCl和Na2CO3;
[进行实验]实验步骤1:碳酸钠溶液显碱性,能使无色的酚酞试液变红色,若取少量烧杯内的溶液于试管中,滴入几滴酚酞溶液,振荡,发现溶液不变色;结论:猜想三不正确。故填:溶液不变色;
因为盐酸和氯化钠均能与硝酸银溶液反应生成氯化银白色沉淀,所以步骤2不能证明猜想二错误;故填:盐酸和氯化钠均能与硝酸银溶液反应生成氯化银白色沉淀;
猜想一的溶液显酸性,猜想二的溶液显中性,所以可用pH试纸来测定溶液的pH来判断;还可以用铁粉或氧化铜来检验溶液是否显酸性,因为铁粉能与盐酸反应生成氯化亚铁和氢气,有气泡产生,氧化铜能与盐酸反应生成氯化铜和水,溶液会变成蓝绿色;而盐酸与铜粉不反应;故填:abd;
[反思交流]烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是腐蚀下水道;故填:腐蚀下水道。

【题目】根据下列溶解度曲线和A物质的部分温度是的溶解度判断下列说法正确的是( )
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | A物质 | 20 | 28 | 45 | 60 |
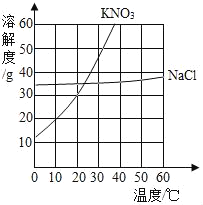
A. 由上图可知,KNO3和NaCl的溶解度均大于A 物质的溶解度
B. 10℃时,将40gNaCl放入50g水中,充分溶解,所得溶液是NaCl的不饱和溶液
C. 将30℃时NaCl、KNO3、和A物质的饱和溶液各降温至10℃,所得溶液的溶质质量分数大小为:KNO3>NaCl>A
D. 20℃时,将KNO3、NaCl和A物质各30g分别配制成恰好饱和溶液,所得溶液的质量大小为A>KNO3=NaCl