题目内容
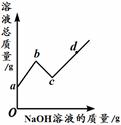
(11分)下图表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化曲线。请从曲线图中获取信息,回答下列问题:
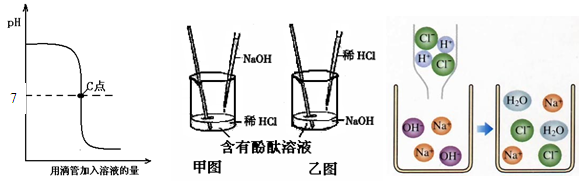
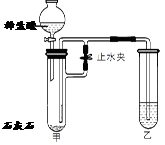
(1)实验操作是按照以上 (甲或乙)图所示进行的,烧杯中溶液的颜色由 色逐渐变为 色。发生反应的化学方程式为 。
(2)实验结束时,老师滴加两滴反应后的溶液到玻璃片上,烘干后出现白色固体。小明说这是氢氧化钠,小刚认为不可能,证据是 ;
(3)右上图是反应的微观变化图,对比反应前后的微粒,此反应的实质是盐酸溶液中的
与氢氧化钠溶液中的氢氧根离子结合,生成了水。酸和碱往往都能发生类似反应,请尝试书写氯酸(HClO3)与氢氧化钾(KOH)反应的化学方程式 。
(4)用溶质的质量分数为36.5%的盐酸20g与足量氢氧化钠溶液恰好完全反应,需要溶质的质量分数为20%的氢氧化钠溶液 g。

(1)实验操作是按照以上 (甲或乙)图所示进行的,烧杯中溶液的颜色由 色逐渐变为 色。发生反应的化学方程式为 。
(2)实验结束时,老师滴加两滴反应后的溶液到玻璃片上,烘干后出现白色固体。小明说这是氢氧化钠,小刚认为不可能,证据是 ;
(3)右上图是反应的微观变化图,对比反应前后的微粒,此反应的实质是盐酸溶液中的
与氢氧化钠溶液中的氢氧根离子结合,生成了水。酸和碱往往都能发生类似反应,请尝试书写氯酸(HClO3)与氢氧化钾(KOH)反应的化学方程式 。
(4)用溶质的质量分数为36.5%的盐酸20g与足量氢氧化钠溶液恰好完全反应,需要溶质的质量分数为20%的氢氧化钠溶液 g。
(1)乙(1分),红(1分),无(1分)。NaOH+HCl="=NaCl" +H2O(2分) (2)(含有酚酞的)烧杯中的溶液呈无色(1分) (3)氢离子(或H+)(1分),KOH+ HClO3 ==KClO3 +H2O(2分) (4)40(2分)
试题分析:(1)从pH图像可知:该操作是向碱性物质中加入酸。所以应按照以上乙图所示进行的。开始时烧杯中的物质为氢氧化钠,呈碱性,烧杯中溶液的颜色为红色;当二者恰好完全反应时,溶液呈中性,溶液颜色为无色。发生反应的化学方程式为NaOH+HCl="=NaCl" +H2O。
(2)从pH图像可知:最后溶液呈酸性。即加入的酸是过量的。所以溶液中不存在氢氧化钠。(或最后溶液呈无色)。
(3)两图对比可知:氯离子和钠离子在反应后仍然存在。所以反应的实质是盐酸溶液中的氢离子与氢氧化钠溶液中的氢氧根离子结合,生成了水。所以氯酸(HClO3)与氢氧化钾(KOH)反应会生成盐和水,化学方程式为:KOH+ HClO3 ==KClO3 +H2O。
(4)根据题意可知,已知量为纯盐酸的质量;未知量为氢氧化钠溶液的质量。解题思路:可根据纯盐酸与氢氧化钠在反应中的质量关系求出所需氢氧化钠溶液的质量。具体解题过程为:
解:设需氢氧化钠溶液的质量为x;
NaOH + HCl="=NaCl" +H2O
40 36.5
20%x 36.5%×20g
40:36.5=20%x:36.5%×20g
x=40g

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目