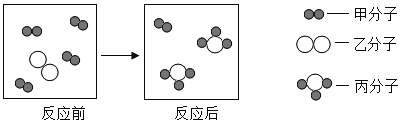
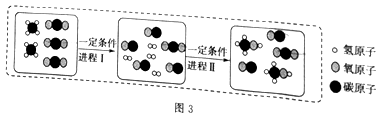
题目内容
【题目】有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种。取样溶于水,有白色沉淀产生;过滤后,向该白色沉淀中滴加盐酸,现象如下图所示(ABC表示沉淀变化,OBC表示气体变化)
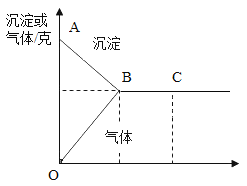
Ⅰ.由此推断原白色固体中一定含有的是_____________;
Ⅱ.C点所得溶液溶质个数为__________个。
【答案】Na2SO4、Na2CO3、BaCl2 2
【解析】
Ⅰ.取样溶于水,有白色沉淀产生,则原白色固体中一定含有氯化钡,因为氯化钡能与碳酸钠生成碳酸钡沉淀,和硫酸钠反应生成硫酸钠沉淀,所以可能含有碳酸钠、硫酸钠至少一种,向沉淀中滴加盐酸,沉淀减少,且有气体生成,但是沉淀并未完全消失,说明该沉淀为碳酸钡和硫酸钡,从而推出原白色固体中一定含有碳酸钠、硫酸钠和氯化钡,不能确定是否含有氢氧化钠;
Ⅱ.向白色沉淀中滴加盐酸,![]() ,C点时,盐酸过量,故C点所得溶液溶质为氯化钡和过量的盐酸,故溶质的个数为2。
,C点时,盐酸过量,故C点所得溶液溶质为氯化钡和过量的盐酸,故溶质的个数为2。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
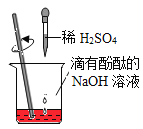
【题目】下列实验操作或结论合理的是
A.区分两种常见氮肥氯化铵和硫酸铵,可以通过取样,分别加入少量熟石灰,研磨分辨
B.除去二氧化锰中的氯化钾,可以通过加水溶解、过滤、蒸发的实验操作达到目的
C.Ca(NO3)2、Na2CO3、NaCl、HNO3不另加试剂就不能将它们区别开来
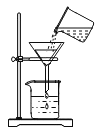
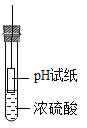
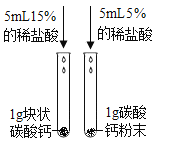
D.在如下图所示的几个实验操作中,错误的操作为②③④
|
|
|
|
①探究酸碱中和 | ②过滤操作 | ③测某浓度浓硫酸的pH | ④探究反应物接触面积对反应速率的影响 |