题目内容
(2012?荆门)随机取一定量的镁粉和铜粉的混合物于烧杯中,再向其中分次加入等质量的同一稀硫酸.实验过程中有关物质的用量及质量测定记录如下表:
请回答下列问题:
(1)随机所取镁粉和铜粉混合物的质量为
(2)实验操作结束后的溶液中溶质的化学式为
(3)所用稀硫酸中溶质的质量分数为
(4)反应后所得溶液的总质量是多少(要有解答过程,结果精确到0.01g)?
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 加入稀硫酸的质量 | 35g | 35g | 35g | 35g |
| 剩余固体的质量 | 8.6g | 7.4g | 6.2g | 5.6g |
(1)随机所取镁粉和铜粉混合物的质量为
9.8
9.8
g;(2)实验操作结束后的溶液中溶质的化学式为
MgSO4、H2SO4
MgSO4、H2SO4
;(3)所用稀硫酸中溶质的质量分数为
14%
14%
;(4)反应后所得溶液的总质量是多少(要有解答过程,结果精确到0.01g)?
分析:镁粉和铜粉的混合物,根据金属活动性顺序镁能与稀硫酸反应而铜不能,由表格中的数据可看出,前三次实验固体质量的减少量是相同的,而第四次的固体减少量比前三次少,说明第四次实验中镁已经完全反应,所以不能用第四次和第三次实验固体质量的差值来计算.
解答:解:(1)由表格中的数据可看出35g稀硫酸完全反应能反应掉金属镁的质量为:8.6g-7.4g=1.2g,故随机所取镁粉和铜粉混合物的质量为:8.6g+1.2g=9.8g
故答案为:9.8
(2)实验操作结束后因部分稀硫酸未完全反应故反应后溶液中溶质为生成的硫酸镁和硫酸
故答案为:MgSO4、H2SO4
(3)设35g稀硫酸中溶质硫酸的质量为x
Mg+H2SO4 ═MgSO4 +H2↑
24 98
8.6g-7.4g x
=
x=4.9g
所用稀硫酸中溶质的质量分数为:
×100%═14%
故答案为:14%
(4)设镁粉完全反应时生成氢气的质量为y
Mg+H2SO4 ═MgSO4 +H2↑
24 2
9.8g-5.6g y
=
y=0.35g
反应后所得溶液的总质量为:35g×4+9.8g-5.6g-0.35g═143.85g
答:反应后所得溶液的总质量为143.85g
故答案为:9.8
(2)实验操作结束后因部分稀硫酸未完全反应故反应后溶液中溶质为生成的硫酸镁和硫酸
故答案为:MgSO4、H2SO4
(3)设35g稀硫酸中溶质硫酸的质量为x
Mg+H2SO4 ═MgSO4 +H2↑
24 98
8.6g-7.4g x
| 24 |
| 8.6g-7.4g |
| 98 |
| x |
x=4.9g
所用稀硫酸中溶质的质量分数为:
| 4.9g |
| 35g |
故答案为:14%
(4)设镁粉完全反应时生成氢气的质量为y
Mg+H2SO4 ═MgSO4 +H2↑
24 2
9.8g-5.6g y
| 24 |
| 9.8g-5.6g |
| 2 |
| y |
y=0.35g
反应后所得溶液的总质量为:35g×4+9.8g-5.6g-0.35g═143.85g
答:反应后所得溶液的总质量为143.85g
点评:此题是表格型计算题,做此题的关键是认真分析表格中的多组数据,找出有利数据来进行解题.

练习册系列答案
相关题目
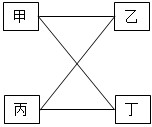 (2012?荆门)下表提供的四组物质中,符合图示相连的两种物质间在一定条件下可以发生化学反应的是( )
(2012?荆门)下表提供的四组物质中,符合图示相连的两种物质间在一定条件下可以发生化学反应的是( )