题目内容
【题目】(10分)在“质量守恒定律”的教学中,老师引导同学们进行“化学反应中反应物与生成物的质量关系”的实验探究,请你参与探究并回答有关问题:
(1)如图A、B所示,将锥形瓶(反应物未接触)放在天平上,右盘加砝码使之平衡,取下锥形瓶,将锥形瓶中两种物质混合,反应完全后将锥形瓶再放回天平左盘上。
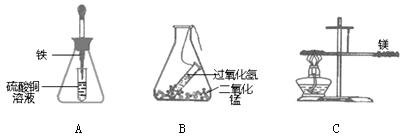
①A瓶重新放回到天平上,天平 (填“能”或“不能”)保持平衡。
②B瓶重新放回到天平上,天平能否保持平衡? ,理由是 。
③从原子的角度分析“质量守恒定律” 。
(2)如上图C所示,用细线系住镁条使之平衡,然后在镁条一端用酒精灯加热。镁条在加热的条件下,能与空气中的氧气反应生成氧化镁。
①写出镁在空气中加热的文字表达式 。
②加热一段时间后,镁条 (填“能”或“不能”)保持平衡。
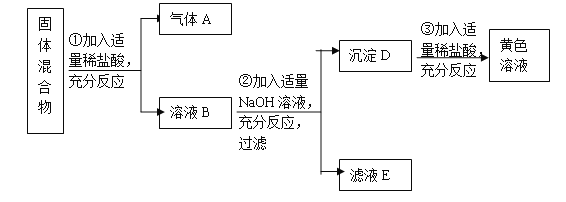
(3)某同学利用如图所示的装置测定空气中氧气的含量(体积分数)。他的操作过程如下(有100mL和500mL量筒供选用):
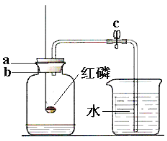
①检查整个装置的气密性后,将c处的止水夹夹紧,点燃红磷后,迅速插入左边的广口瓶中;
②待燃烧停止,整个装 置冷却至室温后,将c处的止水夹打开。结果发现烧杯中的水进入到广口瓶中;
③待烧杯中的水不能再进入广口瓶后,打开广口瓶的橡胶塞,将广口瓶中的水全部倒入到100mL量筒中,测得其中水的体积为76ml。
④该同学又设法准确地测定了广口瓶中空气的体积,数据为400mL。
回答下列问题:①红磷燃烧时最明显的现象是___________________________;
②该同学测得的空气中氧气的体积分数为________%。与理论值21%相比较,产生误差的原因很可能是_____________________(导气管的体积可忽略不计)。
【答案】(1)① 能 ② 不能 , 过氧化氢在二氧化锰的催化作用下生成氧气,气体从锥形瓶中逸出,使锥形瓶中质量减小 。
③ 化学反应中原子的种类、数目、质量都没有改变,所以反应前后的质量总相等 。
(2)① 镁+氧气![]() 氧化镁 ② 不能
氧化镁 ② 不能
(3)① 产生大量白烟 ② 19% 红磷的量不足
【解析】
试题分析:(1)①铁与硫酸铜溶液反应生成硫酸亚铁和铜,没有药品逸出到空气中,所以天平平衡;②B瓶反应产生氧气,容器没有封闭,氧气逸散到空气中,造成质量减少,所以天平不能平衡,指针偏左;③化学反应是原子重新组合的过程,反应过程中,原子的种类、数目、质量都不发生变化,所以总质量守恒。
(2)①镁条与氧气反应生成氧化镁,②加热一段时间后,由于左边的镁生成了氧化镁,导致质量增加,天平不平衡,指针偏左。 (3)红磷燃烧最明显的现象是产生大量白烟,测得氧气的体积分数是76ml/400ml=19% ,偏小的原因主要有三点,一是装置漏气;二是打开止水夹时温度没有冷却到室温,三是红磷的量不足,但由于题干中已明确气密性没有问题,温度也冷却到室温,说明只有一个原因那就是红磷的量不足导致结果偏小。