题目内容
【题目】杂卤石(K2SO4·MgSO4·2 CaSO4·2H2O)属于“呆矿”,为能充分利用钾资源,用饱和的Ca(OH)2溶液浸杂卤石制备硫酸钾,工艺流程如下: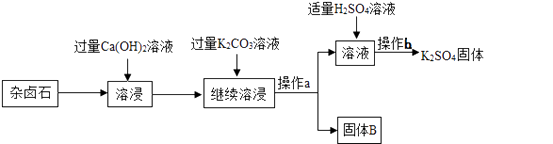
已知:
物质 | CaSO4 | K2SO4 | Mg(OH)2 |
溶解度/g(25℃) | 0.28 | 11.1 | 0.00084 |
(1)操作a的名称为 , 该操作中玻璃棒的作用是_ _。
(2)固体B的主要成分有和。
(3)操作b的步骤是蒸发浓缩、、过滤、洗涤。
(4)在实验流程中加入过量的K2CO3溶液,能除去的物质是;
(5)在使用Ca(OH) 2溶液和K2CO3溶液对杂卤石进行“溶浸”时,为探究获得较高浸出杂卤石主要成分的浸取率,某实验小组用测得浸取液中K+的质量分数来表示浸取率,在相同的时间里,进行了如表实验组:
实验 | 温度/℃ | Ca(OH)2用量/g | K+浸取率/% |
① | 25 | 2.5 | 72.4 |
② | 40 | 2.5 | 86.55 |
③ | 40 | 3 | 90.02 |
④ | 60 | 3 | 91.98 |
⑤ | 60 | 4 | 91.45 |
①上述实验的数据中,温度与K+浸取率的关系是
②如表所列出的5组实验中,若要获得最佳的K+浸取率,选择的反应条件是℃
和g 的Ca(OH) 2用量
【答案】
(1)过滤;引流
(2)Mg(OH)2;CaCO3
(3)降温结晶
(4)CaSO4和Ca(OH)2
(5)温度越高,浸取率越大;60;3
【解析】(1)操作a为固体与液体分离的操作,所以为过滤,过滤时玻璃棒的作用为引流;(2)加入过量氢氧化钙溶液时,会生成氢氧化镁沉淀,再加入过量碳酸钾溶液时,会产生碳酸钙沉淀,所以固体B中有氢氧化镁和碳酸钙;(3)操作b为硫酸钾溶液析出硫酸钾固体,步骤是蒸发浓缩、降温结晶、过滤、洗涤;(4)在实验流程中加入过量的K2CO3溶液,能除去原物质中的硫酸钙和加入的过量的氢氧化钙;(5)由表中数据分析可知,温度越高K+浸取率越大;如表所列出的5组实验中,若要获得最佳的K+浸取率,选择的反应条件是60℃和3g的氢氧化钙。根据题中所给信息结合学过的知识进行分析解答,掌握酸、碱、盐间的反应,能用已知数据进行分析对比是解题关键。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案