题目内容
现有Fe和Fe2O3的固体混合物,东东同学为了分析混合物中Fe和Fe2O3的含量,设计了如图实验方案:
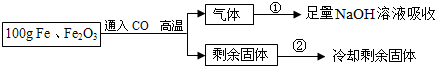
【实验数据】实验共记录了两组实验数据:
第①组,完全吸收气体后,NaOH溶液质量增加了66g;
第②组,完全反应,冷却后称量剩余固体的质量为Wg.
根据实验设计及有关数据进行分析与计算.
(1)根据第①姐数据,CO与Fe2O3,反应产生CO2 g.
(2)混合物中Fe2O3的质量为多少?
(3)第②组数据W是 g.

【实验数据】实验共记录了两组实验数据:
第①组,完全吸收气体后,NaOH溶液质量增加了66g;
第②组,完全反应,冷却后称量剩余固体的质量为Wg.
根据实验设计及有关数据进行分析与计算.
(1)根据第①姐数据,CO与Fe2O3,反应产生CO2
(2)混合物中Fe2O3的质量为多少?
(3)第②组数据W是
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:(1)依据Fe、Fe2O3通入CO 会发生Fe2O3+3CO
2Fe+3CO2的反应,所以生成的气体是二氧化碳,由于二氧化碳能与NaOH溶液反应生成碳酸钠和水,所以NaOH溶液的增重即为二氧化碳的质量;
(2)依据二氧化碳的质量结合方程式即可求出氧化铁的质量;
(3)依据该反应生成的铁的质量和原有铁的质量解决即可;
| ||
(2)依据二氧化碳的质量结合方程式即可求出氧化铁的质量;
(3)依据该反应生成的铁的质量和原有铁的质量解决即可;
解答:解:(1)依据Fe、Fe2O3通入CO 会发生Fe2O3+3CO
2Fe+3CO2的反应,所以生成的气体是二氧化碳,由于二氧化碳能与NaOH溶液反应生成碳酸钠和水,所以NaOH溶液的增重就是二氧化碳的质量;即为66g;
(2)设固体混合物中Fe2O3的质量为x,反应生成的铁的质量是y
Fe2O3+3CO
2Fe+3CO2
160 112 132
x y 66g
=
,
=
解得 x=80g y=56g
(3)第②数据即是生成的铁和原有铁的质量之和,为56g+(100g-80g)=76g;
答案:(1)66; (2)混合物中Fe2O3的质量为80g; (3)76.
| ||
(2)设固体混合物中Fe2O3的质量为x,反应生成的铁的质量是y
Fe2O3+3CO
| ||
160 112 132
x y 66g
| 160 |
| x |
| 132 |
| 66g |
| 112 |
| y |
| 132 |
| 66g |
解得 x=80g y=56g
(3)第②数据即是生成的铁和原有铁的质量之和,为56g+(100g-80g)=76g;
答案:(1)66; (2)混合物中Fe2O3的质量为80g; (3)76.
点评:要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景,结合所学的相关知识和技能,细致地分析题意并细心地探究、推理后,按照题目要求进行认真地解答即可.

练习册系列答案
 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
下列各组物质中,按单质、化合物、混合物顺序排列的是( )
| A、钢、冰水混合物、胆矾 |
| B、铜、空气、浓硫酸 |
| C、生石灰、熟石灰、食盐 |
| D、氧气、铁锈、浓盐酸 |
 (1)现在使用的氮肥大多是尿素[CO(NH2)2]和碳酸氢铵[NH4HCO3],请计算两种氮肥的相对分子质量.
(1)现在使用的氮肥大多是尿素[CO(NH2)2]和碳酸氢铵[NH4HCO3],请计算两种氮肥的相对分子质量.
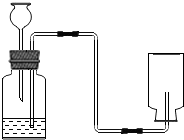 如图是实验室制取CO2装置图.
如图是实验室制取CO2装置图.
 如图为A、B、C三种固体物质(不含结晶水)的溶解度曲线.请回答下列问题:
如图为A、B、C三种固体物质(不含结晶水)的溶解度曲线.请回答下列问题: