题目内容
(2011?闵行区一模)以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.(1)Na2CO3溶解度曲线为(填“a”或“b”).
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
| Na2CO3的溶解度(g/100g水) | 7.1 | 12.5 | 21.5 | 39.7 | 49.0 |
| NaHCO3的溶解度(g/100g水) | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 |
①冷却热饱和溶液 ②蒸发溶剂 ③溶解过滤
(3)已知Na2CO3转化为NaHCO3的反应为Na2CO3+CO2+H2O→2NaHCO3,根据以上信息,要除去NaHCO3饱和溶液中的少量Na2CO3,应采用的化学方法是.
(4)40℃时的100g Na2CO3的饱和溶液中含有g溶质,该溶液的溶质质量分数为%.(计算结果精确到0.1)
(5)若将30%的碳酸钠溶液100g,稀释到10%,需要加水mL.
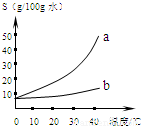
【答案】分析:(1)由Na2CO3、NaHCO3的溶解度表及溶解度曲线,则可知:Na2CO3溶解度曲线为变化趋势大的.
(2)由Na2CO3、NaHCO3的溶解度曲线图,可知要除去Na2CO3固体中的少量NaHCO3,应采用的物理方法;
(3)已知Na2CO3转化为NaHCO3的反应为Na2CO3+CO2+H2O→2NaHCO3,根据以上信息,要除去NaHCO3饱和溶液中的少量Na2CO3,应采用的化学方法是让碳酸钠与二氧化碳反应.
(4)由Na2CO3、NaHCO3的溶解度表,可知40℃时碳酸钠的溶解度,则可求100gNa2CO3的饱和溶液中含有溶质的质量,可求该溶液的溶质质量分数;
(5)若将30%的碳酸钠溶液100g,稀释到10%,根据稀释前后溶质的质量相等,可求需要加水的质量.
解答:解:
(1)由Na2CO3、NaHCO3的溶解度表及溶解度曲线,则可知:Na2CO3溶解度曲线为a.
(2)由图可知,要除去Na2CO3固体中的少量NaHCO3,应采用的物理方法是:冷却热饱和溶液,故选①;
(3)已知Na2CO3转化为NaHCO3的反应为Na2CO3+CO2+H2O→2NaHCO3,根据以上信息,要除去NaHCO3饱和溶液中的少量Na2CO3,应采用的化学方法是:通入过量二氧化碳.因为碳酸钠溶液与二氧化碳反应生成碳酸氢钠;
(4)由表可知,40℃时碳酸钠的溶解度为49.0克,则100gNa2CO3的饱和溶液中含有100×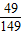 ×100%=32.9g溶质,该溶液的溶质质量分数为
×100%=32.9g溶质,该溶液的溶质质量分数为 ×100%=32.9%;
×100%=32.9%;
(5)若将30%的碳酸钠溶液100g,稀释到10%,因为稀释前后溶质的质量相等,设加水的质量为x,则100×30%=(100+x)×10%,故x=200克,则可知需要加水200mL.
故答为:(1)a;(2)①;(3)通入过量二氧化碳.
(4)32.9g; 32.9%;(5)200ml.
点评:掌握固体溶解度曲线及其作用;了解混合物的分离方法和用水稀释改变浓度的方法.
(2)由Na2CO3、NaHCO3的溶解度曲线图,可知要除去Na2CO3固体中的少量NaHCO3,应采用的物理方法;
(3)已知Na2CO3转化为NaHCO3的反应为Na2CO3+CO2+H2O→2NaHCO3,根据以上信息,要除去NaHCO3饱和溶液中的少量Na2CO3,应采用的化学方法是让碳酸钠与二氧化碳反应.
(4)由Na2CO3、NaHCO3的溶解度表,可知40℃时碳酸钠的溶解度,则可求100gNa2CO3的饱和溶液中含有溶质的质量,可求该溶液的溶质质量分数;
(5)若将30%的碳酸钠溶液100g,稀释到10%,根据稀释前后溶质的质量相等,可求需要加水的质量.
解答:解:
(1)由Na2CO3、NaHCO3的溶解度表及溶解度曲线,则可知:Na2CO3溶解度曲线为a.
(2)由图可知,要除去Na2CO3固体中的少量NaHCO3,应采用的物理方法是:冷却热饱和溶液,故选①;
(3)已知Na2CO3转化为NaHCO3的反应为Na2CO3+CO2+H2O→2NaHCO3,根据以上信息,要除去NaHCO3饱和溶液中的少量Na2CO3,应采用的化学方法是:通入过量二氧化碳.因为碳酸钠溶液与二氧化碳反应生成碳酸氢钠;
(4)由表可知,40℃时碳酸钠的溶解度为49.0克,则100gNa2CO3的饱和溶液中含有100×
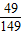 ×100%=32.9g溶质,该溶液的溶质质量分数为
×100%=32.9g溶质,该溶液的溶质质量分数为 ×100%=32.9%;
×100%=32.9%;(5)若将30%的碳酸钠溶液100g,稀释到10%,因为稀释前后溶质的质量相等,设加水的质量为x,则100×30%=(100+x)×10%,故x=200克,则可知需要加水200mL.
故答为:(1)a;(2)①;(3)通入过量二氧化碳.
(4)32.9g; 32.9%;(5)200ml.
点评:掌握固体溶解度曲线及其作用;了解混合物的分离方法和用水稀释改变浓度的方法.

练习册系列答案
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目

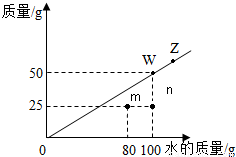 (2011?闵行区一模)t℃时,根据某物质在不同质量的水中达到饱和状态时所溶解的质量绘制成下图中的斜线.下列说法正确的是( )
(2011?闵行区一模)t℃时,根据某物质在不同质量的水中达到饱和状态时所溶解的质量绘制成下图中的斜线.下列说法正确的是( )