题目内容
(12分)请按要求填空
1.请写出相对的化学符号或名称:
①+2价的铜元素______ ②2NO3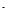 ____ ③2个氧分子______ ④3个银原子
____ ③2个氧分子______ ④3个银原子
2. 请从H、N、O、Ca四种元素中选择恰当的元素,写出符合下列要求物质的化学式:
①改良酸性土壤的碱___________ ②能使湿润红色石蕊试纸变蓝的气体________
③引发硝酸型酸雨的氧化物_______ ④常用作食品干燥剂的物质______________
3.写出符合下列要求的化学方程式:
①绿色植物进行光合作用__________; ②用Al(OH)3治疗胃酸过多__________;
③用硫酸铜湿法炼铜 ; ④甲烷燃烧生成二氧化碳和水___________。
1. 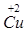 2个硝酸根离子 2O2 3Ag
2个硝酸根离子 2O2 3Ag
2. Ca(OH)2 NH3 NO2 CaO
3. 6CO2 + 6H2O 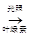 C6H12O6+ 6O2
C6H12O6+ 6O2
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Fe + CuSO4 = FeSO4 + Cu
CH4 + 2O2 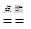 CO2+ 2H2O
CO2+ 2H2O
解析:本题考查的是常见的一些符号、化学式、化学方程式,这些都是需要熟记的内容。

练习册系列答案
相关题目
(12分)请根据下图所提供的仪器,按要求填空:
(1)写出图甲中仪器的名称A D
(2)实验室制取氧气需要选择下列药品中的 (填序号);
| A.大理石 | B.5%过氧化氢溶液 | C.稀盐酸 | D.二氧化锰 |
(4)若要用如图乙中的液体药品除去气体中的水份,请在图乙中将装置补画完整并标出进气和出气方向。______________

(5)实验室若用右图并用排水法收集氧气,则要先在瓶中装满水,氧气应从______
(“a”或“b”)导气管进入。


 ⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应。
⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应。 ⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应。
⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应。