题目内容
【题目】(3分)在13 g锌粉中加入过量的20%的硫酸铜溶液,充分反应后过滤,得到242.2 g溶液,则反应后溶液中剩余的硫酸铜的质量是多少?
【答案】16.4g
【解析】
试题分析:根据反应:Zn + CuSO4 = ZnSO4 + Cu,可计算出参加反应的硫酸铜质量以及生成铜的质量,反应后溶液中剩余的硫酸铜的质量应等于原硫酸铜的总质量减去参加反应的硫酸铜质量
解:设13 g锌消耗的CuSO4质量为x,生成Cu的质量为y
Zn + CuSO4 = ZnSO4 + Cu
65 160 64
13 g ![]() y
y
![]()
![]()
![]() = 32 g y = 12.8 g
= 32 g y = 12.8 g
CuSO4溶液的质量为 242.2 g + 12.8 g - 13 g = 242 g
∴ 剩余的CuSO4 质量为 242 g×20% - 32 g = 16.4 g

练习册系列答案
相关题目
【题目】(7分)水和溶液在生产、生活中起着十分重要的作用。
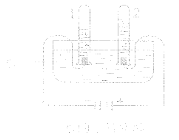
(1)下图是电解水实验装置。在实验过程中,试管1产生的气体是 ,写出水在通电条件下反应的化学方程式 。
(2)将源水处理成自来水的过程中需加入生石灰,生石灰与水反应的化学方程式为__ __。
(3)20℃时,氯化钠的溶解度为36g,则20℃时氯化钠饱和溶液中溶质和溶剂的质量比为 。
(4)为了进行农业选种,现将200g30%的氯化钠溶液稀释为10%的氯化钠溶液,需要加水的质量为 。
(5)自来水中通入少量氯气可以杀菌消毒,化工厂常用浓氨水检测氯气储存设备或者输气管是否有氯气泄漏。A、B、C、D表示4种物质,其微观示意图见下表,A和B在一定条件下反应生成C和D。
物质 | A | B | C | D |
|
化学式 | NH3 | Cl2 | N2 | ||
微观示意图 |
|
|
|
|
D的化学式为 。
若17 g A参加反应,则生成C的质量为 g。