题目内容
【题目】咱们学校化学兴趣小组的同学,对实验室制备氧气的若干问题进行如下探究:
(一)为探究影响双氧水分解速度的某种因素,A小组记录了如下实验数据:
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2的体积 | |
I | 50.0g | 1% | 0.1g | 9mL |
II | 50.0g | 2% | 0.1g | 16mL |
III | 50.0g | 4% | 0.1g | 31mL |
(1)本实验中,测量O2体积的装置是(选填下图1中的装置编号)。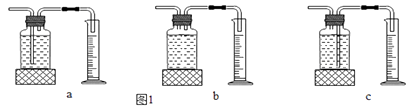
(2)实验结论:在相同条件下, , 双氧水分解速率越快。
(3)B小组用如图2装置进行实验,则该变化的化学反应方程式为 , 通过比较也能达到实验目的。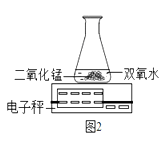
(4)(二)C小组查阅资料:在过氧化氢溶液的分解反应中,氧化铜也能作催化剂。
于是他们用天平称量0.2g氧化铜,取5mL5%过氧化氢溶液于试管中,进行如下实验:
填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦操作 | 结论 |
, 带火星的木条复燃; | ; | 将固体加入盛有5mL5%过氧化氢溶液的试管中,并把带火星的木条伸入试管,观察现象。 | 在过氧化氢溶液的分解反应中,氧化铜也能作催化剂。 |
(5)步骤①的目的是 ,
(6)步骤④对应的实验操作是 ,
(7)步骤⑦是证明。
(8)(三)D小组为探究催化剂的种类对氯酸钾分解速度的影响,设计了以下对比实验:
a.将12.25g KClO3与5.0g MnO2均匀混合加热
b.将12.25g KClO3与5.0g CuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢。通常采用的方法有:
①测相同时间内产生O2的体积;②测。
(9)计算:12.25g KClO3中所含氧元素质量与克过氧化氢中所含氧元素的质量相等?
【答案】
(1)C
(2)双氧水浓度越大
(3)2H2O2 ![]() 2H2O+O2↑,相同时间电子秤读数差值大小。(或电子秤上示数减小的速度或电子秤的读数不再发生变化时,所需要的时间)
2H2O+O2↑,相同时间电子秤读数差值大小。(或电子秤上示数减小的速度或电子秤的读数不再发生变化时,所需要的时间)
(4)有大量气泡产生,固体质量仍为0.2g
(5)与步骤③对比,验证加入氧化铜前后过氧化氢溶液分解速率有无变化
(6)过滤
(7)氧化铜在反应前后化学性质不变
(8)收集相同体积O2所需时间
(9)5.1
【解析】(1)通过进入氧气,提高压强,将水排入量筒,以排出的水的体积来测定氧气的体积,选C;(2)由数据,双氧水浓度越高,相同时间内生成的氧气越多,那么可得实验结论:在相同条件下, 双氧水浓度越大,双氧水分解速率越快;(3)为过氧化氢在二氧化锰催化下分解生成氧气和水;产生氧气越多越快,残留物质的质量就减小的越快,因此可以相同时间电子秤读数差值大小。(或电子秤上示数减小的速度或电子秤的读数不再发生变化时,所需要的时间);(二)催化剂必须要能改变该反应的反应速率,且本身的质量和化学性质不变。(4)步骤①②③为通过对比有无加氧化铜时其分解速率的对比,来证明氧化铜能改变反应速率;步骤④⑤⑥为证明使用后其质量不变;那么还需证明其化学性质不变,即可多次使用;(5)证明氧化铜能改变反应速率;(6)步骤④为分离固体和液体,为过滤操作;(7)能改变反应速率和质量不变也证明,还需化学性质不变;(三)(8)参考物理上对速度的定义①测相同时间内产生O2的体积;②测收集相同体积O2所需时间。(9)设为x,那么12.25g×48/122.5=x×32/34,x=5.1g。
故答案为:C;双氧水浓度越大;2H2O2 ![]() 2H2O+O2↑,相同时间电子秤读数差值大小。(或电子秤上示数减小的速度或电子秤的读数不再发生变化时,所需要的时间);有大量气泡产生;固体质量仍为0.2g;与步骤③对比,验证加入氧化铜前后过氧化氢溶液分解速率有无变化;过滤;氧化铜反应前后化学性质不变;收集相同体积O2所需时间;5.1.
2H2O+O2↑,相同时间电子秤读数差值大小。(或电子秤上示数减小的速度或电子秤的读数不再发生变化时,所需要的时间);有大量气泡产生;固体质量仍为0.2g;与步骤③对比,验证加入氧化铜前后过氧化氢溶液分解速率有无变化;过滤;氧化铜反应前后化学性质不变;收集相同体积O2所需时间;5.1.
本题主要考察影响化学反应速率的因素:一是是否有催化剂,有催化剂比没有催化剂快,二是反应物的接触面积,接触面积越大反应越快,三是反应物的浓度,反应物浓度越大反应越快。催化剂在化学反应前后质量和化学性质都不改变;物质中元素怒的质量等于物质质量乘以该元素的质量分数。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案