题目内容
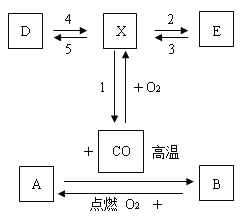
【题目】已知某种无色溶液A中的溶质是KNO3和Na2CO3,另有一种固体样品B,其中可能含有CuO和CuSO4或两者之一,按下图所示进行探究实验,出现的现象如图中所述(设过程中所有反生的反应都恰好完全反应)
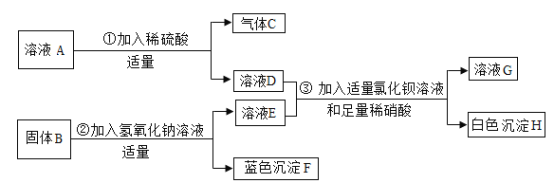
试根据实验过程和图示提供的信息,进行分析推理,填写以下空白:
(1)气体C的化学式为_____,将气体C通入紫色石蕊试液中,试液变_____色。
(2)蓝色沉淀F的化学式_______
(3)溶液E中大量存在的酸根阴离子是______(填写离子符号)
(4)固体B中,一定不存在的物质是_____(填写化学式),得出此结论的理由是______。
(5)溶液G中一定大量存在的阳离子有__________(填写离子符号)
(6)写出步骤③中发生反应的化学方程式_________。
【答案】CO2 红 Cu(OH)2 SO42- CuO 固体B中加入氢氧化钠后,得到溶液和蓝色沉淀,氧化铜是黑色固体 K+、H+、Na+ BaCl2+Na2SO4=BaSO4↓+2NaCl
【解析】
碳酸钠和硫酸反应生成二氧化碳气体,氢氧化钠和硫酸铜反应生成蓝色的氢氧化铜沉淀,硫酸根离子和钡离子反应生成硫酸钡沉淀, 溶液A中加入稀硫酸会生成气体C,固体B中加入氢氧化钠会生成蓝色沉淀和F和溶液E, 所以B中一定不含氧化铜,所以(1)气体C的化学式为CO2,二氧化碳和水反应生成碳酸,碳酸能使紫色石蕊变红色,所以将气体C通入紫色石蕊试液,试液变红色,
(2)蓝色沉淀F化学式为Cu(OH)2,
(3)加入氯化钡和稀硝酸产生大量白色沉淀,所以溶液E中大量存在的酸根阴离子是SO42-,
(4)固体E中,一定不存在的物质是CuO;得出此结论的理由是:固体B中加入氢氧化钠后,得到溶液和蓝色沉淀,氧化铜是黑色固体;
(5)氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,并且稀硝酸过量,硝酸钾一直存在于溶液中,所以溶液G中一定大量存在的阳离子有K+、H+、Na+。
(6)步骤③中发生的反应是氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,化学方程式为:BaCl2+Na2SO4=BaSO4↓+2NaCl。

【题目】某样品为铜和氧化铜的混合物,为测定样品中氧化铜的含量,甲、乙、丙、丁四位同学用同一样品分别进行实验,测定的实验数据如下表。请分析数据解答下列问题:
甲 | 乙 | 丙 | 丁 | |
所取固体样品的质量 | 25 | 25 | 20 | 20 |
加入硫酸溶液质量 | 50 | 100 | 100 | 120 |
反应剩余固体质量 | 21 | 17 | 12 | 12 |
(1)四位同学中, 同学所取的硫酸溶液质量不足(从“甲”、“乙”、“丙” 或“丁”中选择填写);
(2)混合物氧化铜的质量分数为?
(3)硫酸溶液中溶质的质量分数为?