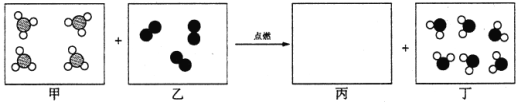
��Ŀ����
����Ŀ����6�֣���ҵ�Ͽ�����ʳ�κ�ʯ��ʯΪԭ����ȡ����(Na2CO3)�������Ĺؼ����ڳ��������� NaCl��NH3��CO2��H2O�����ܶ��ת����NaHCO3������������NH4Cl����Һ������Ҫ�����������£�
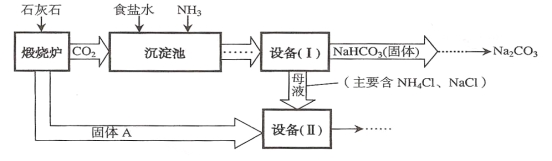
����֪2NH4Cl+Ca(OH)2==CaCl2+2NH3 ��+2H2O��
��1��������¯���з�����Ӧ�Ļ�ѧ����ʽ�� ��
��2������ʵ��������롰�豸��I�����еĻ����õ��IJ����������� ��
��3���ڡ��豸�����й���A��ˮ��Ӧ�Ļ�ѧ����ʽ�� ���÷�Ӧ���� ��Ӧ����д������Ӧ���ͣ���
��4���ԡ��豸�����е�ĸҺ������ˮ������ڱ������������õ������� ����д��ѧʽ����
��5����д��һ�����������̵��ŵ㣺 ��
���𰸡���1�� CaCO3����CaO+CO2�� ��2������ ��3�� CaO + H2O === Ca(OH)2 ����
��4�� NH3��NaCl ��5��ԭ�ϱ����û��е����ʿ���ѭ������
��������
�����������1�� ������¯�����ǽ�ʯ��ʯ���м��ȣ���������Ӧ�Ļ�ѧ����ʽ����CaCO3����CaO+CO2��
��2�� ���롰�豸��I�����еĻ���������յõ����������Һ�������õ��IJ���������������
��3�� ����A����������¯����������Ӧ��������������ƣ������ڡ��豸�����й���A��ˮ��Ӧ�Ļ�ѧ����ʽ����CaO + H2O === Ca(OH)2���÷�Ӧ����������Ӧ
��4���ԡ��豸�����е�ĸҺ�������˿��Եõ�ˮ�������Եõ��Ȼ��ƣ��Լ�����������ǰ�������ͼ�������ж��ڱ������������õ���������NH3��NaCl
��5�����������̵��ŵ���ԭ�ϱ����û��е����ʿ���ѭ������

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����һ��������a��b��c��d�������ʷ���һ�ܱ������У���һ�������·�Ӧһ��ʱ���÷�Ӧ������ʵ��������£�����˵������ȷ���ǣ� ��
�� �� | a | b | c | d |
��Ӧǰ��������g�� | 6.4 | 3.2 | 4.0 | 2.8 |
��Ӧ���������g�� | 5.2 | X | 7.2 | 2.8 |
A��a��c�Ƿ�Ӧ�� B.dһ���Ǵ��� C��X=2.0 D���÷�Ӧ�ǻ��Ϸ�Ӧ