题目内容
(15分)某校兴趣小组同学进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中,有一瓶装有溶液的试剂瓶未盖瓶盖且标签破损(如下图),于是决定对这瓶溶液进行探究:

(1)查阅资料:
①酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠;
②氯化钙溶液呈中性
(2)对这瓶溶液到底是氯化钠、氢氧化钠、碳酸钠中的哪一种,同学们根据现有的药品进行如下实验:
①甲同学取待测液于试管中,滴加无色酚酞试液,溶液呈红色,由此得出结论:该溶液不可能是 溶液,理由是 。
②乙同学另取待测液于试管中,滴加稀盐酸,有 的现象,由此得出结论:该溶液是Na2CO3溶液。
③丙同学认为乙同学的结论不严密,因为NaOH溶液露置在空气中,会与 反应生成Na2CO3,反应的化学方程式为 ,所以这瓶溶液还可能是部分变质的NaOH溶液。
④对这瓶溶液的实际成分,小组同学讨论后,一致认为还需要进行如下实验:

设计步骤Ⅰ的目的是:完全除去溶液中的 ,避免其对 的检验造成干扰。
【实验结论】该溶液是 。
(3)拓展运用:
①做实验时,取用药品后应及时 。
②NaOH溶液与盐酸发生中和反应,是 (选填“吸热”或“放热”)反应。
③除去NaOH溶液中混有的少量Na2CO3溶液,可加入适量的 溶液(填序号)。
A.CaCl2 B.HCl C.Ca(OH)2

(1)查阅资料:
①酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠;
②氯化钙溶液呈中性
(2)对这瓶溶液到底是氯化钠、氢氧化钠、碳酸钠中的哪一种,同学们根据现有的药品进行如下实验:
①甲同学取待测液于试管中,滴加无色酚酞试液,溶液呈红色,由此得出结论:该溶液不可能是 溶液,理由是 。
②乙同学另取待测液于试管中,滴加稀盐酸,有 的现象,由此得出结论:该溶液是Na2CO3溶液。
③丙同学认为乙同学的结论不严密,因为NaOH溶液露置在空气中,会与 反应生成Na2CO3,反应的化学方程式为 ,所以这瓶溶液还可能是部分变质的NaOH溶液。
④对这瓶溶液的实际成分,小组同学讨论后,一致认为还需要进行如下实验:

设计步骤Ⅰ的目的是:完全除去溶液中的 ,避免其对 的检验造成干扰。
【实验结论】该溶液是 。
(3)拓展运用:
①做实验时,取用药品后应及时 。
②NaOH溶液与盐酸发生中和反应,是 (选填“吸热”或“放热”)反应。
③除去NaOH溶液中混有的少量Na2CO3溶液,可加入适量的 溶液(填序号)。
A.CaCl2 B.HCl C.Ca(OH)2
(2)①NaCl或氯化钠(1分)氯化钠溶液呈中性,不能使酚酞试液变色(2分)
②气泡产生(1分)
③二氧化碳或CO2 (1分)2NaOH+CO2=Na2CO3+H2O (3分)
④白色沉淀产生 Na2CO3或CO32- NaOH或OH- (每空1分)
【实验结论】变质的NaOH溶液(1分)
(3)① 盖好瓶盖 ②放热 ③C (每空1分)
②气泡产生(1分)
③二氧化碳或CO2 (1分)2NaOH+CO2=Na2CO3+H2O (3分)
④白色沉淀产生 Na2CO3或CO32- NaOH或OH- (每空1分)
【实验结论】变质的NaOH溶液(1分)
(3)① 盖好瓶盖 ②放热 ③C (每空1分)
(1)①根据氯化钠溶液呈中性,不能使酚酞变红分析即可;②从含有碳酸钠必能和盐酸反应生成二氧化碳的事实分析解决;③因氢氧化钠易变质与空气中的二氧化碳反应会生成碳酸钠,④钙离子盒碳酸根离子生成沉淀碳酸钙,(3)①从氢氧化钠易变质得到启示②NaOH溶液与盐酸发生中和反应,是放热反应,③盐酸和碳酸钠生成氯化钠盒水,二氧化碳

练习册系列答案
相关题目

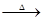 ZnSO4+SO2↑+2H2O计算后。取一定量的锌粉与98%的浓硫酸恰好完全反应。
ZnSO4+SO2↑+2H2O计算后。取一定量的锌粉与98%的浓硫酸恰好完全反应。