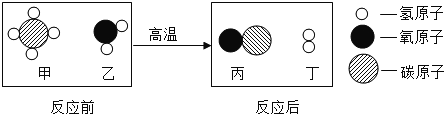
��Ŀ����
����Ŀ���������ȣ�ClO2������������ˮ�������Դ���Ϊԭ������ClO2�Ĺ�����Ҫ������
�ٷ�Ӧ���Ǵ��γ��ӣ�
�ڷ�Ӧ�������������µ��NaCl��Һ��NaClO3��
�۷�Ӧ����ClO2����ȡ�����з�Ӧ����ȡClO2�Ļ�ѧ����ʽΪ��2NaClO3+4HCl�T2ClO2��+Cl2��+2NaCl+2H2O��
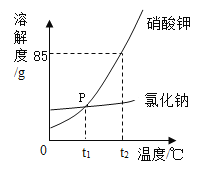
����������ͼ��
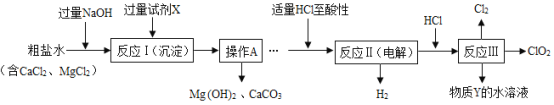
��1����������������Ƶ�Ŀ����________��
��2���������Լ�X��____���ѧʽ��������A��������_______��
��3���������ClO2��Cl�Ļ��ϼ�Ϊ_______��
��4����������HCl��Ϊ��������ʱ�������⣬���ܳ�ȥ��Һ�е��������ӣ���д���������������кͷ�Ӧ�Ļ�ѧ����ʽ��___________��
��5���������п�ѭ�����õ�������ˮ��________��
���𰸡������Ȼ�þ Na2CO3 ���� +4 NaOH+HCl=NaCl+H2O �Ȼ��ơ�
��������
��1���Ȼ�þ���������Ʒ�Ӧ����������þ�������Ȼ��ƣ���˼�������������Ƶ�Ŀ���dz����Ȼ�þ��
��������Ȼ�þ��
��2��̼���ƺ��Ȼ��Ʒ�Ӧ����̼��Ƴ������Ȼ��ƣ��������Լ�X��Na2CO3��������ȥ��Һ�е��Ȼ��ƣ�����A�������ǹ��ˣ�ͨ�������ܹ���Һ�������롣
���Na2CO3�����ˡ�
��3����ClO2��ClԪ�صĻ��ϼ�Ϊx����Ԫ�صĻ��ϼ���-2�����������У�x+��-2����2=0��x=+4��
���+4��
��4��ϡ�����̼���Ʒ�Ӧ�����Ȼ��ơ�ˮ�Ͷ�����̼�����ڸ��ֽⷴӦ��ϡ������������Ʒ�Ӧ�����Ȼ��ƺ�ˮ�������кͷ�Ӧ��ϡ������������Ʒ�Ӧ�Ļ�ѧ����ʽΪ��NaOH+HCl�TNaCl+H2O��
���NaOH+HCl�TNaCl+H2O��
��5���������п�ѭ�����õ�������ˮ���Ȼ��ơ�
����Ȼ��ơ�