题目内容
某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸.请计算:
(1)若要清洗100kg的这种石油产品,需要________千克的NaOH.
(2)改石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸.每处理100kg这种产品,可以节约________的经费.
NaOH和Ca(OH)2的市场价格如表:
| 名称 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 6.0 | 24.00 |
解:(1)设需要NaOH的质量为x,
2NaOH+H2SO4=Na2SO4+2H2O
80 98
x 100kg×4.9%
∴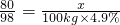
∴x=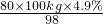 =4kg;
=4kg;
(2)设需要Ca(OH)2的质量为y,
Ca(OH)2+H2SO4=CaSO4+2H2O
74 98
y 100kg×4.9%
∴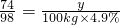
∴y=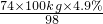 =3.7kg;
=3.7kg;
采用NaOH中和这些残余硫酸所需经费:4kg×24.00元/kg=96元;
采用Ca(OH)2中和这些残余硫酸所需经费:3.7kg×6元/kg=22.2元;
可以节约的经费:96元-22.2元=73.8元.
故答案为:
(1)4;
(2)73.8元.
分析:(1)利用氢氧化钠与硫酸反应的化学方程式和硫酸的质量,列出比例式,就可计算出需要NaOH的质量;
(2)利用氢氧化钙与硫酸反应的化学方程式和硫酸的质量,列出比例式,就可计算出需要Ca(OH)2的质量;
然后根据图示数据,分别计算出采用NaOH和采用Ca(OH)2中和这些残余硫酸所需经费,得出它们的差,就是可以节约的经费.
点评:本题主要考查学生利用化学方程式进行计算的能力.解题时要结合图表数据,认真分析解答.
2NaOH+H2SO4=Na2SO4+2H2O
80 98
x 100kg×4.9%
∴
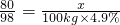
∴x=
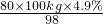 =4kg;
=4kg;(2)设需要Ca(OH)2的质量为y,
Ca(OH)2+H2SO4=CaSO4+2H2O
74 98
y 100kg×4.9%
∴
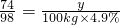
∴y=
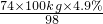 =3.7kg;
=3.7kg;采用NaOH中和这些残余硫酸所需经费:4kg×24.00元/kg=96元;
采用Ca(OH)2中和这些残余硫酸所需经费:3.7kg×6元/kg=22.2元;
可以节约的经费:96元-22.2元=73.8元.
故答案为:
(1)4;
(2)73.8元.
分析:(1)利用氢氧化钠与硫酸反应的化学方程式和硫酸的质量,列出比例式,就可计算出需要NaOH的质量;
(2)利用氢氧化钙与硫酸反应的化学方程式和硫酸的质量,列出比例式,就可计算出需要Ca(OH)2的质量;
然后根据图示数据,分别计算出采用NaOH和采用Ca(OH)2中和这些残余硫酸所需经费,得出它们的差,就是可以节约的经费.
点评:本题主要考查学生利用化学方程式进行计算的能力.解题时要结合图表数据,认真分析解答.

练习册系列答案
相关题目
下表列举了四组待鉴别的物质和对应的鉴别方法,其中合理的是
| 待鉴别的物质 | 鉴别方法 | |
| A | 纯碱和熟石灰 | 加入无色酚酞,观察溶液颜色的变化 |
| B | H2、CO、CO2 | 用燃着的木条检验,观察木条燃烧情况 |
| C | 食盐水和烧碱溶液 | 滴加稀盐酸溶液,观察有无气泡产生 |
| D | 硝酸铵和生石灰 | 加水溶解,用手触摸试管外壁温度的变化 |
- A.A
- B.B
- C.C
- D.D
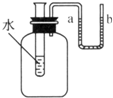 如图所示,向小试管中分别加入一定量的下列物质,右侧U型管中液面发生明显变化,加入的固体物质不是
如图所示,向小试管中分别加入一定量的下列物质,右侧U型管中液面发生明显变化,加入的固体物质不是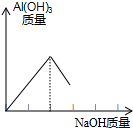
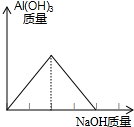
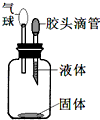 要使如图装置中的小气球鼓起来,应选用固体和液体是
要使如图装置中的小气球鼓起来,应选用固体和液体是