题目内容
【题目】某兴趣小组的同学称取石灰石样品25.0g,高温煅烧至质量不再改变,反应过程中剩余固体物质的质量与反应时间的关系如图所示.试计算(杂质均不参与反应): 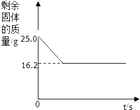
(1)生成二氧化碳质量是g.
(2)石灰石样品中碳酸钙的质量分数是多少?(写出计算过程)
(3)若取50克该石灰石样品与足量的稀盐酸反应,生成二氧化碳的质量为g.
【答案】
(1)8.8
(2)解:设样品中碳酸钙的质量为x
CaCO3 |
| CO2↑ |
100 | 44 | |
x | 8.8g |
![]()
x=20g
石灰石样品中碳酸钙的质量分数是: ![]() 100%=80%
100%=80%
(3)17.6
【解析】解:(1)生成二氧化碳质量为:25g﹣16.2g=8.8g,(3)设生成二氧化碳的质量为y
CaCO3 | +2HCl═CaCl2+H2O+ | CO2↑ |
100 | 44 | |
50g×80% | y |
![]()
y=17.6g
所以答案是:(1)8.8;(2)石灰石样品中碳酸钙的质量分数是80%;(3)17.6
【考点精析】解答此题的关键在于理解根据化学反应方程式的计算的相关知识,掌握各物质间质量比=系数×相对分子质量之比.

练习册系列答案
相关题目