题目内容
【题目】CuCl常用作有机合成工业的催化剂,它是一种白色粉末,不溶于水,在空气中很容易被氧化为绿色固体Cu2(OH)3Cl。以粗盐水(含CaCl2、MgCl2、Na2SO4)、Cu等原料制取CuCl的工艺如下图: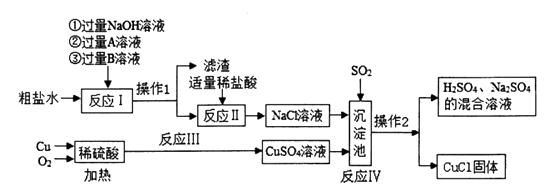
(1)CuCl的名称是 , 操作1、操作2中用到的玻璃仪器有玻璃棒、烧杯和。
(2)反应I中,依次加入试剂①②③,若A为BaCl2溶液,则B为溶液,加入该溶液的目的是。
(3)写出反应II中不属于中和反应的化学方程式:。
(4)在工业上进行反应III时,常加入足量稀硫酸并通入过量的氧气,其目的是。
(5)沉淀池中有H2O参与反应,该反应Ⅳ中有种元素的化合价发生变化。
(6)CuCl易被空气氧化的原理为:4CuCl+4H2O+O2=2Cu2(OH)3Cl+2A,则A为。
【答案】
(1)氯化亚铜,漏斗
(2)碳酸钠(或 Na2CO3),除去 CaCl2 和过量的 BaCl2(或除去 Ca2+和 Ba2+)
(3)Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
(4)使铜充分反应(或提高铜的利用率)
(5)2
(6)HCl
【解析】(1)CuCl的名称是氯化亚铜,操作1、操作2中用到的玻璃仪器有玻璃棒、烧杯和漏斗;(2)反应I中,依次加入试剂①②③,若A为BaCl2溶液,则B为碳酸钠溶液,加入该溶液的目的是除去氯化钙和过量的氯化钡;(3)反应II中,稀盐酸和氢氧化钠反应生成氯化钠和水,属于中和反应,和碳酸钠反应生成氯化钠、水和二氧化碳,不属于中和反应,碳酸钠和稀盐酸反应的化学方程式为: Na2CO3+2HCl═2NaCl+H2O+CO2↑;(4)在工业上进行反应III时,常加入足量稀硫酸并通入过量的氧气,其目的是使铜充分反应;(5)沉淀池中有H2O参与反应,该反应Ⅳ中,二氧化硫中的硫元素由+4变成+6,硫酸铜中的铜元素由+2变成+1,因此反应Ⅳ中有2种元素的化合价发生变化;(6)由4CuCl+4H2O+O2=2Cu2(OH)3Cl+2A可知,反应前后铜原子都是4个,氧原子都是6个,反应前氯原子是4个,反应后应该是4个,其中2个包含在2A中,反应前氢原子是8个,反应后应该是8个,其中2个包含在2A中,则A为HCl。
【考点精析】利用过滤操作的注意事项和质量守恒定律及其应用对题目进行判断即可得到答案,需要熟知过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损;①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏.

 阅读快车系列答案
阅读快车系列答案