题目内容
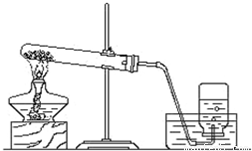
某同学加热氯酸钾和二氧化锰的混合物制取氧,已知二氧化锰质量为
0.1克,当制得所需的氧气后,冷却,称量剩余固体物质,其质量为4.04克.继续加热,最后又制得氧气0.96克.求原混合物中氯酸钾的质量.
答案:
解析:
解析:
|
由 0.96克氧气求出4.04克固体中未分解的氯酸钾质量为2.45克,则第一次加热后,生成氯化钾的质量为1.49克,从而求出第一次分解的氯酸钾质量为2.45克,即可得出氯酸钾的总质量为4.9克. |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 下列是某同学加热氯酸钾和二氧化锰制取氧气,装置图如图:
下列是某同学加热氯酸钾和二氧化锰制取氧气,装置图如图: