题目内容
【题目】)已知木炭还原氧化铜实验中发生的主要反应:C+2CuO![]() 2Cu+CO2↑.化学兴趣小组对该实验产物(假设反应物已完全反应)作如下探究:
2Cu+CO2↑.化学兴趣小组对该实验产物(假设反应物已完全反应)作如下探究:
探究一:检验产物的成份
【提出问题】实验产物是暗红色固体,很难观察到紫红色固体.暗红色固体是什么?
【查阅资料】氧化亚铜(Cu2O)为红色固体;Cu2O+H2SO4═CuSO4+Cu+H2O.
【猜想与假设】暗红色固体除铜外还可能含有Cu2O.
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到现象: ,说明暗红色固体含有Cu2O.
探究二:测定产物中Cu2O的含量
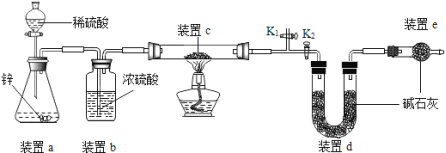
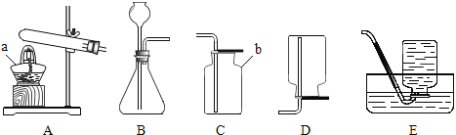
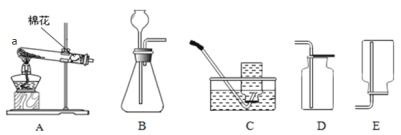
原理:Cu2O+H2![]() 2Cu+H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
2Cu+H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
(1)装置a中用稀硫酸而不用稀盐酸,原因是 ;
(2)若不加装置e,实验结果会偏高,原因是 ;
(3)点燃酒精灯前涉及的部分操作如下,正确的顺序是
①打开K2,关闭K1 ②检查装置的气密性
③连接仪器 ④关闭K2,打开K1,通氢气一段时间
(4)还可通过测定反应前后装置 (填“a”、“b”或“c”)的质量达到实验目的.
【答案】探究一:固体部分溶解,溶液变成蓝色.探究二:(1) 盐酸易挥发,挥发出的氯化氢能被碱石灰吸收,影响测定结果.(2) d中的碱石灰能够吸收空气中的水和二氧化碳;(3) ③②④①.(4)C
【解析】
试题分析:探究一:
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到固体部分溶解,溶液变成蓝色,说明暗红色固体含有Cu2O.探究二:
(1)装置a中用稀硫酸而不用稀盐酸,原因是盐酸易挥发,挥发出的氯化氢能被碱石灰吸收,影响测定结果.(2)若不加装置e,实验结果会偏高,原因是d中的碱石灰能够吸收空气中的水和二氧化碳,从而使测定的水的质量偏高,会导致计算的Cu2O的质量偏高,从而导致实验结果会偏高.(3)点燃酒精灯前涉及的部分操作如下,正确的顺序是:先连接仪器,检查装置的气密性,再关闭K2,打开K1,通氢气一段时间,把装置中的水蒸气和二氧化碳排出,再打开K2,关闭K1,点燃酒精灯.(4)还可通过测定反应前后装置c的质量达到实验目的,反应前后装置c的质量差即为Cu2O中氧元素的质量,根据氧元素的质量可以计算Cu2O的质量,进一步可以计算产物中Cu2O的含量.

 中考解读考点精练系列答案
中考解读考点精练系列答案