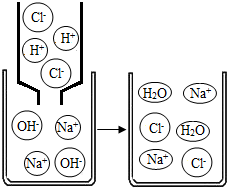
题目内容
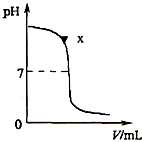 19、某兴趣小组同学对NaOH溶液与稀盐酸发生中和反应进行探究,设计了如下实验:同学们把两种无色溶液分别贴上A、B标签,向烧杯中倒入一定量的A溶液并测定其pH,再向溶液中逐滴加入B溶液,并不断振荡,同时测定混合液的pH,pH变化情况如图.
19、某兴趣小组同学对NaOH溶液与稀盐酸发生中和反应进行探究,设计了如下实验:同学们把两种无色溶液分别贴上A、B标签,向烧杯中倒入一定量的A溶液并测定其pH,再向溶液中逐滴加入B溶液,并不断振荡,同时测定混合液的pH,pH变化情况如图.(1)由此可推断,同学们向烧杯中倒入的A溶液是
NaOH
溶液(填化学式).(2)图中x点表示的溶液呈
碱
性,其溶液中的溶质有NaCl、NaOH
(填化学式).(3)若某同学向A溶液中逐滴加入B溶液时,出现一个异常的现象:冒气泡,写出产生气泡的原因(用两个相关的化学方程式表示).
2NaOH+CO2=Na2CO3+H2O
;Na2CO3+2HCl=2NaCl+H2O+CO2↑
.分析:氢氧化钠溶液呈碱性,其PH大于7,盐酸呈酸性,其PH小于7,氢氧化钠溶液和盐酸可以发生中和反应生成氯化钠和水,恰好完全反应时其PH等于7,,氢氧化钠过量时显碱性,盐酸过量时显酸性;氢氧化钠易与二氧化碳反应生成碳酸钠而变质,生成的碳酸钠遇酸生成气体二氧化碳.
解答:解:
(1)由图象可以看出,开始时溶液的PH大于7,可以确定是向氢氧化钠溶液中滴加盐酸,故答案为:NaOH;
(2)X点对应的溶液PH大于7,表明溶液呈碱性,此时溶液中有氢氧化钠和生成的氯化钠,故答案为:碱; NaOH,NaCl;
(3)向A溶液中逐滴加入B溶液时冒气泡,说明溶液中含有碳酸钠,其原因在于氢氧化钠易与二氧化碳反应生成碳酸钠而变质,生成的碳酸钠遇酸生成二氧化碳气体.
故答案为:2NaOH+CO2=Na2CO3+H2O,Na2CO3+2HCl=2NaCl+CO2↑+H2O.
(1)由图象可以看出,开始时溶液的PH大于7,可以确定是向氢氧化钠溶液中滴加盐酸,故答案为:NaOH;
(2)X点对应的溶液PH大于7,表明溶液呈碱性,此时溶液中有氢氧化钠和生成的氯化钠,故答案为:碱; NaOH,NaCl;
(3)向A溶液中逐滴加入B溶液时冒气泡,说明溶液中含有碳酸钠,其原因在于氢氧化钠易与二氧化碳反应生成碳酸钠而变质,生成的碳酸钠遇酸生成二氧化碳气体.
故答案为:2NaOH+CO2=Na2CO3+H2O,Na2CO3+2HCl=2NaCl+CO2↑+H2O.
点评:本题考查了氢氧化钠和盐酸的反应,以及碳酸盐的检验,完成此题,可以依据已有的知识进行.所以要求同学们在平时的学习中加强基础知识的储备.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


 ”.然而化学方程式中最后一种物质的化学式印刷不清楚,根据上下文了解到该物质是一种酸,请根据已学知识推测其化学式:
”.然而化学方程式中最后一种物质的化学式印刷不清楚,根据上下文了解到该物质是一种酸,请根据已学知识推测其化学式: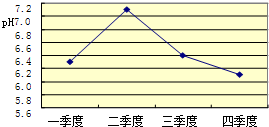
 铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.图1是稀释浓硫酸实验的示意图.
铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.图1是稀释浓硫酸实验的示意图.