题目内容
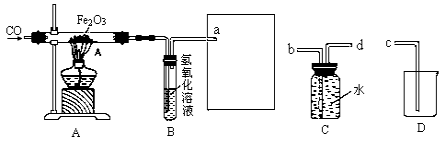
【题目】某化学兴趣小组用一氧化碳与氧化铁的反应来探究炼铁的原理,装置如下图所示,请回答有关问题:

(1)实验进行一段时间之后,A玻璃管内观察到的现象是 。
(2)B装置中氢氧化钠溶液的作用是 。
(3)为避免将CO排放到空气中,并回收利用CO,方框中连接的是C和D装置,导管接口的连接顺序应为
a→ → →
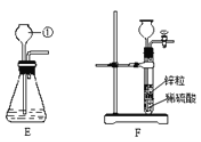
(4)除CO外,还有氢气等物质可以还原Fe2O3,某同学设计了用金属锌粒与稀硫酸反应制取氢气的实验装置,如图所示:

①制取氢气的反应方程式为 。
②用E和F装置制取二氧化碳,F装置与E装置比较,优点是 。
【答案】(1)红色固体变黑(2)吸收CO2
(3)a→d→b→c (4)①Zn+H2SO4==ZnSO4+H2↑②可控制反应的发生或停止。
【解析】
试题分析:(1)在A管中,一氧化碳会与红色的氧化铁反应生成铁粉(黑色)和二氧化碳;所以会观察红色固体变黑。
(2)氢氧化钠能与A中反应生成的二氧化碳气体反应生成碳酸钠和水,从而达到除去二氧化碳的目的。反应的化学方程式为:2NaOH+CO2==Na2CO3+H2O
(3)为避免一氧化碳排入空气中污染空气,应将一氧化碳气体收集起来。所以可用C装置来收集。由于气体的密度比水小,所以气体应从d管通入瓶中。气体会在瓶内上部聚集。由于气压的增大,可将水从b管排出,然后再接c管即可将水排入烧杯中。所以连接顺序为a→d→b→c
(4)①锌可与稀硫酸反应生成氢气和硫酸锌,此反应可用来在实验室中制取氢气。反应的化学方程式为:Zn+H2SO4==ZnSO4+H2↑
②F装置可将锌粒放在多孔板上,当关上开关时试管内的气压变大,可将稀硫酸压入漏斗中;从而使锌与硫酸分离反应停止。当打开开关时,漏斗中的硫酸再回到试管内,与锌接触反应开始。所以F的优点为可控制反应的发生或停止。