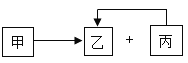题目内容
【题目】海洋中蕴含丰富的资源.
(1)海水淡化是解决淡水资源不足的重要方法.下列方法中,可以使海水变为淡水的是 (填字母序号).
A.滤纸过滤 B.吸附
C.沉降 D.蒸馏
(2)从海水中提炼出来的重水(D2O)可作原子能反应堆的中子减速剂和热传热介质.重水中重氢原子(D)的相对原子质量是2,则重水中氢元素的质量分数为 .
(3)从海水中制备纯碱和金属镁的流程如图所示:

回答下列问题:
①步骤Ⅴ中所加试剂是 .
②粗盐水中主要含有CaCl2、MgSO4等可溶性杂质,可加入下了物质,利用过滤等操作进行除杂,则加入下列三种物质的先后顺序为 (填字序号).
A.适量的盐酸
B.稍过量的Na2CO3溶液
C.稍过量的Ba(OH)2溶液
③第Ⅲ歩反应的化学方程式是 .
④在海边用贝壳作原料制生石灰,比用石灰石作原料的优点是 (写一条).
【答案】
(1)D;
(2)80%;
(3)①稀盐酸(或HCl);②c b a;③2NaHCO3![]() Na2CO3+CO2↑+H2O;④减少贝壳污染(或提高经济效益、减少资源浪费等其他合理答案也可)
Na2CO3+CO2↑+H2O;④减少贝壳污染(或提高经济效益、减少资源浪费等其他合理答案也可)
【解析】
试题分析:
(1)A、过滤是除去不溶性杂质的方法,不能除去水中的可溶性物质,故错误;B、吸附是除去水中色素、异味等不溶性杂质的一种方法,不能除去水中的氯化钠、氯化镁等可溶性盐,故错误;C、沉降是使大颗粒不容物快速沉淀下来,不能除去水中的可溶性物质,故错误;D、蒸馏是通过加热的方法将水变成水蒸气,再冷凝成水的方法,可以得到最纯的蒸馏水,故可将水淡化,正确;
(2)重水中的重氢原子的相对原子质量为2,则氧元素质量分数为:![]() =80%;
=80%;
(3)①氢氧化镁为白色沉淀,与盐酸反应生成氯化镁;②粗盐水中主要含有CaCl2、MgSO4等可溶性杂质,所加试剂的顺序是加稍过量的Ba(OH)2溶液,除去MgSO4,再加稍过量的Na2CO3溶液,除去CaCl2,最后加适量的盐酸,中和前后过量的Ba(OH)2和Na2CO3.③第Ⅲ歩反应是加热碳酸氢钠,其化学方程式为2NaHCO3![]() Na2CO3+CO2↑+H2O;④在海边用贝壳作原料制生石灰,比用石灰石作原料的优点既可减少贝壳污染又可提高经济效益.故答案为:(1)D;(2)80%;(3)①稀盐酸(或HCl);②c b a;③2NaHCO3
Na2CO3+CO2↑+H2O;④在海边用贝壳作原料制生石灰,比用石灰石作原料的优点既可减少贝壳污染又可提高经济效益.故答案为:(1)D;(2)80%;(3)①稀盐酸(或HCl);②c b a;③2NaHCO3![]() Na2CO3+CO2↑+H2O;④减少贝壳污染(或提高经济效益、减少资源浪费等其他合理答案也可)
Na2CO3+CO2↑+H2O;④减少贝壳污染(或提高经济效益、减少资源浪费等其他合理答案也可)

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】对下列日常生活生产中的现象或事实解释不合理的是
生活中的现象 | 解释 | |
A | 春暖花开,香气宜人 | 分子在不断运动 |
B | 洗洁精清洗餐具上油污 | 洗洁精能溶解油污 |
C | 铁制品在潮湿地方易生锈 | 铁生锈过程是铁与氧气、水发生复杂的化学反应 |
D | 活性炭用作冰箱去味剂 | 活性炭具有吸附性 |