题目内容
“黄铜”是铜锌合金,具有较机械性能,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的.现取20.0g某种黄铜投入154.7g某浓度的稀硫酸中,恰好完全反应后剩余的溶液和残余固体总质量为174.5g.请计算:(1)产生氢气的质量为多少g?
(2)这种黄铜中铜的质量分数为多少?
(3)反应后溶液中溶质的质量分数是多少?
分析:(1)因为反应中有氢气生成,所以反应后烧杯中物质的总质量会减少,而且总质量的减少量就是生成氢气的质量;
(2)因为铜锌合金中只有锌和稀硫酸反应,所以可根据锌和稀硫酸反应的化学方程式,利用氢气的质量得到锌的质量,从而得到铜的质量,然后再求出铜的质量分数;
(3)根据锌和稀硫酸反应的化学方程式,利用氢气的质量得到反应后溶质硫酸锌的质量,然后再计算出反应后溶液的质量,最后根据溶质质量分数的公式,得到溶液中溶质的质量分数.
(2)因为铜锌合金中只有锌和稀硫酸反应,所以可根据锌和稀硫酸反应的化学方程式,利用氢气的质量得到锌的质量,从而得到铜的质量,然后再求出铜的质量分数;
(3)根据锌和稀硫酸反应的化学方程式,利用氢气的质量得到反应后溶质硫酸锌的质量,然后再计算出反应后溶液的质量,最后根据溶质质量分数的公式,得到溶液中溶质的质量分数.
解答:解:(1)产生氢气的质量=20.0g+154.7g-174.5g=0.2g
(2)设锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.2g
=
x=6.5g
所以铜的质量为:20.0g-6.5g=13.5g
所以黄铜中铜的质量分数为:
×100%=67.5%
(3)设生成的硫酸锌的质量为y
=
y=16.1g
反应后溶液的质量为:174.5g-13.5g=161g
所以反应后溶液中溶质的质量分数为:
×100%=10%
答:(1)产生氢气的质量为0.2g;
(2)这种黄铜中铜的质量分数为67.5%;
(3)反应后溶液中溶质的质量分数是10%.
(2)设锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.2g
| 65 |
| 2 |
| x |
| 0.2g |
x=6.5g
所以铜的质量为:20.0g-6.5g=13.5g
所以黄铜中铜的质量分数为:
| 13.5g |
| 20.0g |
(3)设生成的硫酸锌的质量为y
| 161 |
| 2 |
| y |
| 0.2g |
y=16.1g
反应后溶液的质量为:174.5g-13.5g=161g
所以反应后溶液中溶质的质量分数为:
| 16.1g |
| 161g |
答:(1)产生氢气的质量为0.2g;
(2)这种黄铜中铜的质量分数为67.5%;
(3)反应后溶液中溶质的质量分数是10%.
点评:此题是利用化学方程式和溶质质量分数相结合的计算题,用反应后总质量的减少量来求反应生成气体的质量是此类题常用的方法,此题虽步骤较多,但解题思路清晰,计算并不复杂,属于中等难度的题目.

练习册系列答案
相关题目
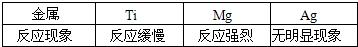
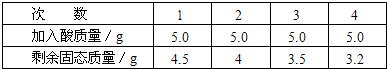
 用化学式表示下列物质
用化学式表示下列物质