题目内容
元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息| 1 H 氢 |
2 He 氦 | ||||||
| 3 Li 锂 |
4 Be 铍 |
5 B 硼 |
6 C 碳 |
7 N 氮 |
8 O 氧 |
9 F 氟 |
10 Ne 氖 |
| 11 Na 钠 |
12 Mg 镁 |
13 Al 铝 |
14 Si 硅 |
15 P 磷 |
16 S 硫 |
17 Cl 氯 |
18 Ar 氩 |
(1)空气中含量最多的元素名称是
(2)
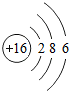 所表示的粒子符号为
所表示的粒子符号为(3)由原子序数为8和13的两种元素组成的化合物是
(4)元素周期表同一横行元素的排列规律是从左至右
分析:(1)空气中含量最多的元素名称是氮元素;由上表可知,其原子的质子数;
(2)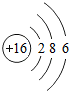 所表示的粒子为硫,可用元素符号表示;由上表可知,其最外层电子数;
所表示的粒子为硫,可用元素符号表示;由上表可知,其最外层电子数;
(3)因为原子序数为8的元素为氧元素,质子数为13的元素为铝元素,它们形成的化合物为氧化铝;
(4)由上表可观察归纳,元素周期表同一横行元素的排列规律是从左至右的规律.
(2)
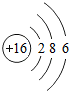 所表示的粒子为硫,可用元素符号表示;由上表可知,其最外层电子数;
所表示的粒子为硫,可用元素符号表示;由上表可知,其最外层电子数;(3)因为原子序数为8的元素为氧元素,质子数为13的元素为铝元素,它们形成的化合物为氧化铝;
(4)由上表可观察归纳,元素周期表同一横行元素的排列规律是从左至右的规律.
解答:解:(1)空气中含量最多的元素名称是氮元素;由上表可知,其原子的质子数为7;
(2)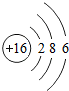 所表示的粒子为硫,可用元素符号表示为S;由上表可知,其最外层电子数为6;
所表示的粒子为硫,可用元素符号表示为S;由上表可知,其最外层电子数为6;
(3)因为原子序数为8的元素为氧元素,质子数为13的元素为铝元素,它们形成的化合物为氧化铝;已知铝元素的化合价为+3价,氧元素的化合价为-2价,标注化合价
,利用化合价数值交叉法书写化学式A12O3
(4)由上表可观察归纳,元素周期表同一横行元素的排列规律是从左至右的规律:原子序数(核电荷数)依次增大、(或由金属逐渐过渡到非金属).
故答为:(1)氮;7;(2)S;6;(3)A12O3;(4)原子序数(核电荷数)依次增大、(或由金属逐渐过渡到非金属)(合理给分)
(2)
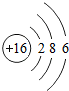 所表示的粒子为硫,可用元素符号表示为S;由上表可知,其最外层电子数为6;
所表示的粒子为硫,可用元素符号表示为S;由上表可知,其最外层电子数为6;(3)因为原子序数为8的元素为氧元素,质子数为13的元素为铝元素,它们形成的化合物为氧化铝;已知铝元素的化合价为+3价,氧元素的化合价为-2价,标注化合价
| +3 |
| Al |
| -2 |
| O |
(4)由上表可观察归纳,元素周期表同一横行元素的排列规律是从左至右的规律:原子序数(核电荷数)依次增大、(或由金属逐渐过渡到非金属).
故答为:(1)氮;7;(2)S;6;(3)A12O3;(4)原子序数(核电荷数)依次增大、(或由金属逐渐过渡到非金属)(合理给分)
点评:了解元素周期表的特点及其应用;了解化学式的书写及意义;了解原子结构示意图与离子结构示意图的特点.

练习册系列答案
相关题目
 所表示的粒子符号为
所表示的粒子符号为
 所表示的粒子符号为
所表示的粒子符号为 所表示的粒子符号为
所表示的粒子符号为 所表示的粒子符号为
所表示的粒子符号为