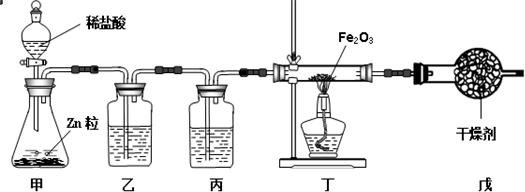
题目内容
写出下列物质之间能发生反应的化学方程式:(写出4个化学方程式即可)
Zn Fe2O3 HCl Ca(OH)2 Na2CO3 AgNO3
①________ ②________
③________ ④________.
Zn+2HCl=ZnCl2+H2↑ Fe2O3+6HCl=2FeCl3+3H2O Ca(OH)2+2HCl=CaCl2+2H2O Na2CO3+2HCl=2NaCl+H2O+CO2↑
分析:根据金属的化学性质、酸的化学性质、盐的化学性质,根据化学方程式的书写方法、步骤进行书写即可.
解答:①活泼金属能与酸反应生成盐和氢气,锌的活动性比氢强,能与盐酸反应生成氯化锌和氢气,反应的化学方程式为:Zn+2HCl=ZnCl2+H2↑.
②金属氧化物能与酸反应生成盐和水,氧化铁能与盐酸反应生成氯化铁的水,反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O.
③酸碱能发生中和反应,盐酸能与氢氧化钙反应生成氯化钙和水,反应的化学方程式为:Ca(OH)2+2HCl=CaCl2+2H2O.
④碳酸盐能与酸反应生成盐、水、二氧化碳,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑.
故答案为:①Zn+2HCl=ZnCl2+H2↑;②Fe2O3+6HCl=2FeCl3+3H2O;③Ca(OH)2+2HCl=CaCl2+2H2O;④Na2CO3+2HCl=2NaCl+H2O+CO2↑.
点评:本题难度不是很大,解题的关键是掌握金属的化学性质、酸的化学性质、盐的化学性质、化学方程式的书写方法等.
分析:根据金属的化学性质、酸的化学性质、盐的化学性质,根据化学方程式的书写方法、步骤进行书写即可.
解答:①活泼金属能与酸反应生成盐和氢气,锌的活动性比氢强,能与盐酸反应生成氯化锌和氢气,反应的化学方程式为:Zn+2HCl=ZnCl2+H2↑.
②金属氧化物能与酸反应生成盐和水,氧化铁能与盐酸反应生成氯化铁的水,反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O.
③酸碱能发生中和反应,盐酸能与氢氧化钙反应生成氯化钙和水,反应的化学方程式为:Ca(OH)2+2HCl=CaCl2+2H2O.
④碳酸盐能与酸反应生成盐、水、二氧化碳,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑.
故答案为:①Zn+2HCl=ZnCl2+H2↑;②Fe2O3+6HCl=2FeCl3+3H2O;③Ca(OH)2+2HCl=CaCl2+2H2O;④Na2CO3+2HCl=2NaCl+H2O+CO2↑.
点评:本题难度不是很大,解题的关键是掌握金属的化学性质、酸的化学性质、盐的化学性质、化学方程式的书写方法等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
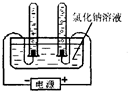 29、小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题:
29、小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题: