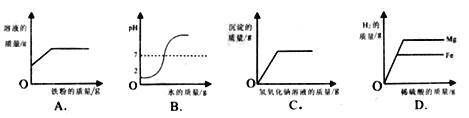
题目内容
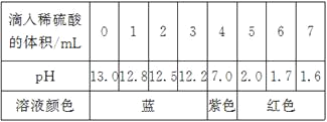
【题目】A、B、C、D分别是氯化钠、硝酸钡、氢氧化钠和盐酸四种无色溶液中的一种,现用一种无色溶液X把A、B、C、D一一鉴别了出来,已知X是含有镁元素的化合物,鉴别方法见图所示。(所加溶液均过量,使反应完全)
完成下列问题:
(1)确定A、B、C、D、X各代表什么物质(用化学式表示):A________,B________,C________,D________,X________。
(2)写出下列有关反应的化学方程式:
X和B:________________________________________________________________________。
X和D:________________________________________________________________________。
【答案】HCl Ba(NO3)2 NaCl NaOH MgSO4 MgSO4+Ba(NO3)2===Mg(NO3)2+BaSO4↓ MgSO4+2NaOH===Na2SO4+Mg(OH)2↓
【解析】
(1)由于X含Mg2+,能将Mg2+沉淀的是OH-,说明B、D中的一种物质是氢氧化钠.
由于X能与四种物质产生两种沉淀,因此X含有的阴离子必然能将Ba2+沉淀,说明B、D中的另一种物质是硝酸钡,同时说明A、C分别是氯化钠和盐酸中的一种,还能说明X中的阴离子可能为CO32-、SO42-.
由于A、C与X不反应,MgCO3易溶于酸,因此X不能是MgCO3,只能是MgSO4.
由于X与B产生的沉淀不溶于A、C,说明产生的沉淀为BaSO4,B为Ba(NO3)2;
由于X与D产生的沉淀溶于A,说明产生的沉淀是Mg(OH)2,A为盐酸,化学式为HCl,C为NaCl,D为NaOH.
(2)硫酸镁与硝酸钡反应生成硝酸镁和硫酸钡沉淀.
该反应的化学方程式为:MgSO4+Ba(NO3)2═Mg(NO3)2+BaSO4↓.
硫酸镁与氢氧化钠反应生成硫酸钠和氢氧化镁沉淀.
该反应的化学方程式为:MgSO4+2NaOH═Na2SO4+Mg(OH)2↓.

【题目】空气中氧气含量测定的再认识:
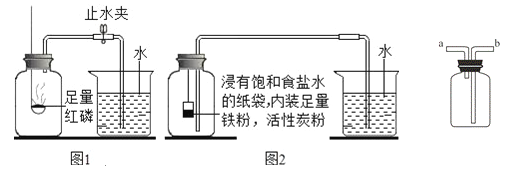
【实验回顾】如图1是实验室用红磷燃烧来粗略测定空气中氧气含量的装置。
(1)写出红磷燃烧的文字表达式: 。
(2)实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内 减小,烧杯中水倒吸到集气瓶.若装置的气密性良好,操作规范,用量筒测量进入瓶中水的体积,能粗略测得空气中氧气的含量。
【问题提出】有实验资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测量结果与理论值误差较大。
【实验改进】
Ⅰ、根据铁在空气中生锈的原理设计如图2实验装置,再次测定空气中氧气含量。装置中的饱和食盐水、活性炭会加速铁生锈。
Ⅱ、测得实验数据如下表:
测量项目 | 实验前 | 实验后 | |
烧杯中水的 体积 | 烧杯中剩余的 体积 | 集气瓶(扣除内容物)和导管的 容积 | |
体积/mL | 80.0 | 54.5 | 126.0 |
【交流表达】(1)铁生锈过程中发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁,写出该反应的文字表达式: 。
(2)根据表中数据计算,改进实验后测得的空气中氧气的体积分数是 (计算结果精确到0.1%)。
(3)从实验原理角度分析,改进后的实验结果比前者准确度更高的原因是:
① ;② 。