题目内容
某化学小组为探究酸碱中和反应,进行了一系列活动.
(1)在实验室配制所需的稀硫酸和氢氧化钠溶液.配制稀硫酸时需将浓硫酸稀释,正确操作是 ;在称量氢氧化钠固体时应将药品放在 称量.
(2)小明同学取少量配制的氢氧化钠溶液加入试管中,滴入1-2滴酚酞溶液,溶液变红色,可是过了一会儿红色就消失了.针对这意外现象的成因同学们作了如下猜想:
甲:可能是酚酞变质造成; 乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故
丁:可能与氢氧化钠溶液浓度有关.
①甲同学刚提出自己的猜想,就遭到其他同学的一致否定,其他同学的理由是
②许多同学认为乙同学的猜想也不正确,理由是
③若丁同学的猜想正确,请设计实验如下表来证明.填表
(3)小芳同学用16g溶质质量分数为5%的氢氧化钠溶液与10g溶质质量分数为10%的稀硫酸反应,然后向其中滴加1-2滴酚酞溶液,溶液为无色,认为此时溶液呈中性.请你通过计算(写出计算过程)来判断反应后溶液的pH 7(填“大于”、“小于”或“等于”).
(1)在实验室配制所需的稀硫酸和氢氧化钠溶液.配制稀硫酸时需将浓硫酸稀释,正确操作是
(2)小明同学取少量配制的氢氧化钠溶液加入试管中,滴入1-2滴酚酞溶液,溶液变红色,可是过了一会儿红色就消失了.针对这意外现象的成因同学们作了如下猜想:
甲:可能是酚酞变质造成; 乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故
丁:可能与氢氧化钠溶液浓度有关.
①甲同学刚提出自己的猜想,就遭到其他同学的一致否定,其他同学的理由是
②许多同学认为乙同学的猜想也不正确,理由是
③若丁同学的猜想正确,请设计实验如下表来证明.填表
| 实验方法 | 可能观察到的现象和结论 |
分析:(1)根据浓硫酸的密度比水大,稀释时放出大量的热,氢氧化钠在水中易潮解进行分析;
(2)①根据酸碱指示剂遇到酸碱盐的显色进行分析;
②根据氢氧化钠变质后的物质进行分析;
③根据氢氧化钠的浓度设计不同的实验进行验证;
(3)根据氢氧化钠和硫酸的量结合方程式中的比例关系进行分析解答.
(2)①根据酸碱指示剂遇到酸碱盐的显色进行分析;
②根据氢氧化钠变质后的物质进行分析;
③根据氢氧化钠的浓度设计不同的实验进行验证;
(3)根据氢氧化钠和硫酸的量结合方程式中的比例关系进行分析解答.
解答:解:(1)浓硫酸密度比空气密度大,稀释时放出大量的热,将水加入浓硫酸中后,会产生危险,氢氧化钠极易潮解,故答案为:把浓硫酸沿器壁慢慢注入水里,并不断搅拌,小烧杯中;
(2)①小明同学取少量配制的氢氧化钠溶液加入试管中,滴入1-2滴酚酞溶液,溶液变红色,说明酚酞没有变质,故答案为:加入酚酞后溶液已经出现了红色;
②氢氧化钠和空气中的二氧化碳生成的碳酸钠也显碱性,会使酚酞变红色,故答案为:碳酸钠溶液显碱性;
③再配制溶液浓度远小于原溶液的氢氧化钠,滴入酚酞,观察颜色的变化情况,
(3)从方程式可知,2NaOH+H2SO4=Na2SO4+2H2O
氢氧化钠和硫酸是按照80:98的比例进行反应的,但是实际氢氧化钠和硫酸是:0.8:1,硫酸过量,所以,反应后硫酸有剩余,故答案为:小于.
(2)①小明同学取少量配制的氢氧化钠溶液加入试管中,滴入1-2滴酚酞溶液,溶液变红色,说明酚酞没有变质,故答案为:加入酚酞后溶液已经出现了红色;
②氢氧化钠和空气中的二氧化碳生成的碳酸钠也显碱性,会使酚酞变红色,故答案为:碳酸钠溶液显碱性;
③再配制溶液浓度远小于原溶液的氢氧化钠,滴入酚酞,观察颜色的变化情况,
| 实验方法 | 可能观察到的现象和结论 |
| 取少量浓度较小的氢氧化钠,滴入无色酚酞, | 若溶液变红色后,颜色不变,说明与氢氧化钠溶液浓度有关. |
氢氧化钠和硫酸是按照80:98的比例进行反应的,但是实际氢氧化钠和硫酸是:0.8:1,硫酸过量,所以,反应后硫酸有剩余,故答案为:小于.
点评:在解此类题时,首先分析题中考查的问题,然后结合题中的反应原理和学过的知识进行分析解答.

练习册系列答案
相关题目
 24、同学们在探究碱溶液与酚酞溶液作用的实验时,发现了一个意外现象:向氢氧化钠溶液中滴入酚酞溶液(如图),溶液变成了红色,但是一会儿红色就消失了.为此某化学小组的同学进行了如下探究.
24、同学们在探究碱溶液与酚酞溶液作用的实验时,发现了一个意外现象:向氢氧化钠溶液中滴入酚酞溶液(如图),溶液变成了红色,但是一会儿红色就消失了.为此某化学小组的同学进行了如下探究.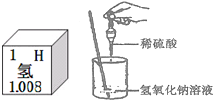 酸、碱、盐是初中化学学习的重要内容,同学们在实验室对酸、碱、盐的性质进行探究.
酸、碱、盐是初中化学学习的重要内容,同学们在实验室对酸、碱、盐的性质进行探究.
 (2013?许昌一模)某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动.
(2013?许昌一模)某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动.