题目内容
【题目】小康同学在老师的指导下,设计如下装置验证碳酸钙的性质的同时,探究氧化钙与二氧化碳在加热的条件下是否也能发生反应生成碳酸钙。

(1)当B中出现_________________的现象时,说明A中发生了反应,A中反应的化学方程式为_______________________________________。
(2)实验后小弘同学对D中是否也发生了反应进行如下探究:
取一定量的D中固体于试管中,并加入一定量的水,振荡,有白色不溶物。小烨同学认为试管中的固体为碳酸钙,即D中确实发生了反应;小彭同学认为上述实验不足以证明D中发生了反应,其理由是_________________________________________________;她又重新设计实验,她的实验步骤及现象为______________________________________________________________。
【答案】石灰水变浑浊  氧化钙和水反应生成的氢氧化钙是微溶物质,加入一定量的水后,有白色不溶物也可能是氢氧化钙; 取样品,加入足量的盐酸,有气体产生,证明有碳酸钙
氧化钙和水反应生成的氢氧化钙是微溶物质,加入一定量的水后,有白色不溶物也可能是氢氧化钙; 取样品,加入足量的盐酸,有气体产生,证明有碳酸钙
【解析】
(1)碳酸钙高温下分解反应生成氧化钙和二氧化碳,反应的化学方程式为: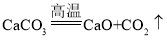 ;二氧化碳能使澄清石灰水变浑浊,故B中石灰水变浑浊;
;二氧化碳能使澄清石灰水变浑浊,故B中石灰水变浑浊;
(2)氧化钙与水反应生成的氢氧化钙是微溶于水的物质,故得到的白色不溶物可能是氢氧化钙;要证明碳酸钙存在,由于碳酸钙能与盐酸反应产生气体,应加入稀盐酸,但防止有剩余的氧化钙和水反应生成氢氧化钙消耗盐酸,所以应加入足量盐酸反应,有气体生成,则证明有碳酸钙生成。

【题目】酱油在使用及储藏过程中颜色会变深,逐渐降低品质。实验小组通过实验研究温度、氧气、光照3个因素对酱油颜色的影响。
(查阅资料)① 通过色差仪检测L*值可监控酱油颜色变化,酱油颜色越深,L*值越小。
② 保鲜瓶具有的特点是挤出盛放的物质后,空气不会进入。
(实验准备)
将等量样品(同品牌、同批次、初始L*值为43.82的酱油)分装到500 mL的不同容器中,密封。
(进行实验)
实验1:将装有样品的多个透明玻璃瓶置于不同温度的恒温箱中。每15天,分别取出未开封样品,用色差仪检测L*值,结果如下。
编号 | 温度 | 15天 | 30天 | 45天 |
1-1 | 5 ℃ | 43.77 | 43.53 | 42.91 |
1-2 | 28 ℃ | 43.71 | 43.19 | 42.85 |
1-3 | 45 ℃ | 43.67 | 42.55 | 40.89 |
实验2:将装有样品的两个容器置于28 ℃的恒温箱中。每15天,分别倒出100 mL酱油,剩余样品放回恒温箱。用色差仪检测倒出样品的L*值,结果如下。
编号 | 容器 | 15天 | 30天 | 45天 |
2-1 | 透明玻璃瓶 | 43.45 | 42.36 | 41.30 |
2-2 | 透明保鲜瓶 | 43.72 | 42.98 | 42.53 |
实验3:将装有样品的多个容器置于28 ℃的恒温箱中。每15天,分别取出未开封样品,用色差仪检测L*值,结果如下。

(解释与结论)
(1)实验1得出的结论是_____。
(2)实验2的目的是_____。
(3)实验3欲研究光照对酱油颜色的影响,应选用的容器是_____。
(4)家庭常使用透明玻璃瓶盛放酱油。解释“在相同时间内,使用过的酱油比未开封的酱油颜色深”可依据的实验是_____(填编号)。
(反思与评价)
(5)结合本实验,你对使用或储藏酱油的建议是_____。
(6)酱油在酿造过程中,有时会产生过量的铵盐(如NH4Cl)影响酱油的口感。可用碳酸钠除去铵盐,原理如下,补全该反应的化学方程式。Na2CO3 + 2NH4Cl === 2NaCl + 2NH3↑ + H2O +_____
【题目】某化学小组在探究碱的化学性质时,做了如图所示的两个实验。
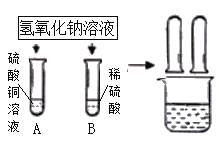
(1)写出A试管中发生反应的化学方程式________。
(2)实验结束后,同学们将A、B两试管中的废液倒入同一洁净的烧杯,烧杯中出现蓝色沉淀.小组同学将烧杯中的物质进行了过滤,对滤液中成分有如下猜想:
(提出猜想)甲:滤液中的溶质是Na2SO4
乙:滤液中的溶质是Na2SO4 、 H2SO4
丙:滤液中的溶质是Na2SO4 、 CuSO4
丁:滤液中的溶质是______
(交流讨论)同学们对以上的猜想提出质疑,认为猜想______不合理,理由是______
(设计实验)同学们通过以下的实验对猜想进行验证,请你完成实验报告。
实验内容 | 预计现象 | 预计结论 |
①取少量滤液于试管中,观察 | 溶液呈无色 | 猜想_____不成立 |
②继续在上述试管中加入______ | ______ | 猜想丁成立 |