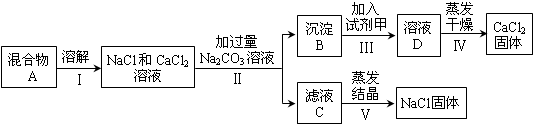
题目内容
酸、碱、盐是重要的化合物,它们之间能发生复分解反应。
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有 生成。
(2)某化学小组进行“酸和碱的中和反应”实验:将盐酸滴入一定量氢氧化钠溶液中,实验无明显现象。为确定反应后溶液中有哪些成分,同学们进行了实验探究。请填写下表:
(3)实验反思:无明显现象的中和反应可借助 判断反应终点。
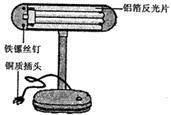
(4)右边是某趣味实验装置图。挤压胶头滴管后,可观察到气球胀大的现象。请分析其原因,并写出化学方程式。

(5)某工厂利用铁屑与硫酸起反应来制取硫酸亚铁。现有稀硫酸49t,
与足量铁屑起反应,可生产7.6 t硫酸亚铁,试计算稀硫酸中溶质
的质量分数是多少?
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有 生成。
(2)某化学小组进行“酸和碱的中和反应”实验:将盐酸滴入一定量氢氧化钠溶液中,实验无明显现象。为确定反应后溶液中有哪些成分,同学们进行了实验探究。请填写下表:
| 实验操作 | 测定结果 | 溶液成分 |
| ①用pH试纸测定反应后溶液的酸碱度,操作方法是 。 | ②若pH>7 | |
| ③若 | NaCl |
(3)实验反思:无明显现象的中和反应可借助 判断反应终点。
(4)右边是某趣味实验装置图。挤压胶头滴管后,可观察到气球胀大的现象。请分析其原因,并写出化学方程式。

(5)某工厂利用铁屑与硫酸起反应来制取硫酸亚铁。现有稀硫酸49t,
与足量铁屑起反应,可生产7.6 t硫酸亚铁,试计算稀硫酸中溶质
的质量分数是多少?
(1)水;(2)①用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较;②NaCl、NaOH(或氯化钠、氢氧化钠);③pH=7
(3)酸碱指示剂(或答出具体的酸碱指示剂也可)(4)CO2被浓NaOH溶液吸收,锥形瓶内的气压成小,外界大气压大于锥形瓶内的气压,使气球胀大; 2NaOH + CO2 =Na2CO3 + H2O;(5)10%
(3)酸碱指示剂(或答出具体的酸碱指示剂也可)(4)CO2被浓NaOH溶液吸收,锥形瓶内的气压成小,外界大气压大于锥形瓶内的气压,使气球胀大; 2NaOH + CO2 =Na2CO3 + H2O;(5)10%
试题分析:(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有水生成;(2)①用pH试纸测定反应后溶液的酸碱度,操作方法是用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较;②若pH>7溶液成分为氯化钠和氢氧化钠;③若pH="7" ,溶液成分为氯化钠;(3)实验反思:无明显现象的中和反应可借助酸碱指示剂判断反映的终点;(4)挤压胶头滴管后,可观察到气球胀大的现象。其原因为CO2被浓NaOH溶液吸收,锥形瓶内的气压成小,外界大气压大于锥形瓶内的气压,使气球胀大;,化学方程式为2NaOH + CO2 =Na2CO3 + H2O
(5)解:设硫酸的质量分数为X。
Fe + H2SO4 = FeSO4 + H2↑
98 152
49t×X 7.6t
98:152 = 49 t×X :7.6 t
X = 10%
答:硫酸的质量分数10%。

练习册系列答案
 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目