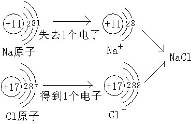
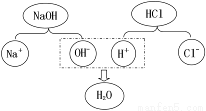
题目内容
(6分)水和溶液是生活中常见的物质,按要求回答相关的问题。
(1)下列所说的“水”属于纯净物的是 。
A.矿泉水 B.蒸馏水 C.自来水 D.雨水
(2)下列能区分软水和硬水的物质是 。
A.食盐水 B.肥皂水 C.食醋 D.苏打水
(3)下列物质与水充分混合后,能形成溶液的是 。
A.花生油 B.白糖 C.纯碱 D.食盐
(4)20℃时,向两只试管中加入等质量的甲、乙两种固体物质,分别加入10g水,使其充分溶解,观察到如图1所示的现象。图2是甲、乙两种物质的溶解度曲线。
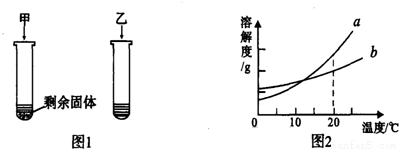
①20℃时,一定是饱和溶液的是 。(填“甲”或“乙”)
②图2中表示甲物质的溶解度曲线的是 。(填“a”或“b”)
③若不考虑水分的蒸发,将甲升温至固体全部溶解,其溶液中溶质的质量分数 。(填“变大”、“变小”或“不变”)
(1)B (2)B (3)BCD (4)①甲 ② b ③变大
【解析】
试题分析:(1)A矿泉水C自来水D雨水等自然界中的水都属于混合物。B蒸馏水属于纯净物。
(2)鉴别硬水和软水的方法:肥皂水或洗衣粉水加到软水中产生较多的泡沫,加到硬水中产生的泡沫很少,且有较多的浮渣。
(3)A.花生油不溶于水,加入水中会分层,不符合均一、稳定的混合物的特点;所以不能形成溶液。B.白糖C.纯碱D.食盐三者均能溶于水,形成均一、稳定的混合物,形成溶液。
(4)①甲中有剩余固体,即无法继续溶解,所以一定为饱和溶液。
②从图1可知,在20℃时相同质量的水中甲溶解的少,乙溶解的多。即在20℃时,甲的溶解度要小于乙的溶解度。所以图2中表示甲物质的溶解度曲线的是b。
③若不考虑水分的蒸发,将甲升温至固体全部溶解,其溶液中溶质的质量会变大,所以溶质的质量分数会变大。
考点:纯净物和混合物的区分、鉴别硬水和软水的方法、溶液的形成、溶解度曲线

 暑假作业海燕出版社系列答案
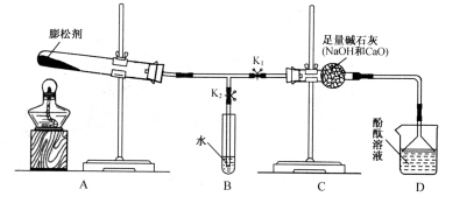
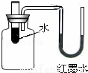
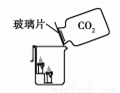
暑假作业海燕出版社系列答案(8分)(1)小方用下图所示装置对二氧化碳的灭火实验进行研究,
观察到的现象是____________________________________。
实验的结论是______________________________________。
(2)【提出问题】二氧化碳能否支持燃烧?
【猜想假设】镁能在二氧化碳中燃烧。
【查阅资料】①氧化镁、氢氧化镁均是白色难溶于水的固体。
②MgO+2HCl= MgCl2+H2O 、
③MgCl2+2NaOH=Mg(OH)2↓+2NaCl 。
【实验探究】
①下图中镁带剧烈燃烧,冒白烟,有黑色固体生成,并放出大量的热。
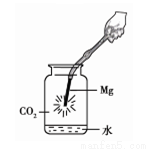
②为检验生成物的成分,做如下实验。
实验步骤 | 实验现象 | 实验结论和化学方程式 | |
向广口瓶中加入过量盐酸,充分反应后过滤,在滤纸上留有黑色固体。 | I、将黑色固体收集、洗涤、干燥后,点燃,在火焰上方罩一个蘸有澄清石灰水的烧杯。 | 黑色固体燃烧,烧杯内壁出现白色浑浊。 | 黑色固体是______; 反应的化学方程式是: ___________________。 |
II、取少量滤液于试管中,逐滴加入氢氧化钠溶液。 | 开始_______,后有白色沉淀产生。 |
白烟的成分是______。 | |
③为了回收II中的白色沉淀,证明沉淀完全的实验方法是______________________
___________________________________(要求写出步骤、试剂、现象和结论)。
【反思提高】实验室中由某些活泼金属引起的着火,不能用二氧化碳灭火,应用细沙灭火。