题目内容
【题目】A、B、C、D、E、F六种物质都是初中化学学习过程中涉及到的有关化合物,它们之间的转化关系如图所示,其中D是最常见的溶剂,B俗称是生石灰。
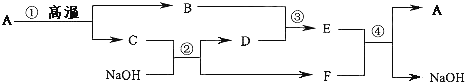
(1)根据图推断,B是 __________,F是 _______________(填写化学式).
(2)写出反应②的化学方程式 __________________________________;
(3)反应③的化学方程式_______________________________________。
(4)反应③属于______________ 反应(用“吸热”或“放热 ”填空)。
【答案】 CaO Na2CO3 2NaOH+CO2=Na2CO3+H2O CaO+ H2O = Ca(OH)2 放热
【解析】本题主要考查物质的鉴别、推断;反应类型的判定;书写化学方程式。本题属于推断题,根据题目给出的流程图和信息:D是最常见的溶剂, D是水;B俗称是生石灰,因此B是氧化钙,碳酸钙在高温的条件下生成氧化钙和二氧化碳,C是二氧化碳;二氧化碳与氢氧化钠溶液反应生成碳酸钠和水;氧化钙和水反应生成氢氧化钙,氢氧化钙的俗名是熟石灰或消石灰;氢氧化钙和碳酸钠溶液反应生成碳酸钙白色沉淀和氢氧化钠,因此E是氢氧化钙,F是碳酸钠.化合反应是“多变一”.
(1)B俗称是生石灰,因此B是氧化钙,A高温能分解生成B和C,则A为碳酸钙,B为氧化钙,则C为二氧化碳,,二氧化碳与氢氧化钠反应生成的D,D是常见的溶剂,所以D为水,能与氧化钙反应生成E,所以E为氢氧化钙,F为碳酸钠,E和F反应生成碳酸钙A和氢氧化钠.所以本题答案为:CaO;Na 2 CO 3
(2)碳酸钙能分解生成氧化钙和二氧化碳,氢氧化钠与二氧化碳反应生成碳酸钠和水,水和氧化钙反应生成氢氧化钙,所以本题答案为:2NaOH+CO 2 ═Na 2 CO 3 +H 2 O
(3)B是氧化钙,D是水,所以反应的化学方程式为:CaO+ H2O = Ca(OH)2
(4)氧化钙和水反应放出大量的热,所以是放热反应。故填:放热

【题目】某校化学兴趣小组的同学 设计了如图所示的简易灭火器,他们对反应后废液的成分展开了探究:
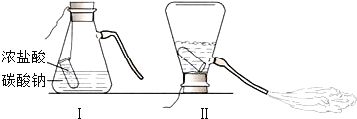
提出问题:反应后的废液中含有哪些成分?
猜想与实验:上图反应的化学方程式为 _______________________________,
由此推出废液中一定含有氯化钠溶液,可能含有碳酸钠溶液或盐酸.
实验一:确定该废液中是否含有盐酸
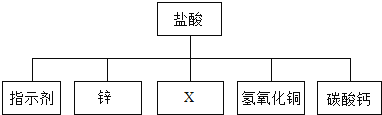
(1)选择试剂:根据盐酸的化学性质(即酸的通性),同学们选择了下图所示五种不同类别的物质,其中,X可以是 __________(填一种具体物质化学式).
(2)实验验证:某同学取少量废液于试管中,向其中加入少量锌粒,观察到 ______,确定废液中一定不含有盐酸.
实验二:确定废液中是否还有碳酸钠
实验操作 | 现象 | 结论 |
取少量废液于试管中,滴加少 量的氢氧化钙溶液 | ______ | 废液中含有碳酸钠。 有关化学方程式:_______。 |
实验三:处理废液,回收氯化钠
欲从废液中得到纯净的氯化钠,向废液中加入过量的__________,再经过蒸发结晶即可得到纯净的氯化钠晶体。
【题目】某化学小组在课外活动时做了一个实验,在甲试管中装入某固体物质,乙试管装入某溶液,按如图所示组装好仪器(图中铁架台等仪器已略去).打开止水夹,同时通过分液漏斗加入足量稀盐酸,看到乙试管溶液中有气泡冒出,一段时间后,再关闭止水夹,发现乙中溶液变白色浑浊.
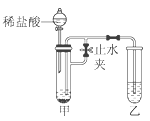
符合此实验现象的一组试剂是:
选项 | 甲中固体 | 乙中溶液 |
A | CaCO3 | Ca(OH)2 |
B | CuCO3 | NaOH |
C | Mg | AgNO3 |
D | KOH | BaCl2 |
A. A B. B C. C D. D