题目内容
(2013?平江区二模)某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如下实验方案:
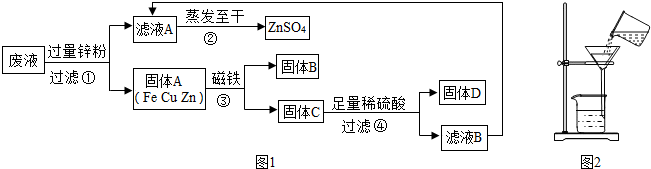
试回答:
(1)在图1步骤①中锌粉必须过量的原因是
(2)据图1写出步骤①中任一反应的化学方程式为
(3)检验图1步骤④中加入的稀硫酸是否足量的方法是
(4)指出如图2的过滤操作的错误
(5)若实验过程中的物质损失忽略,最终所得硫酸锌的质量

试回答:
(1)在图1步骤①中锌粉必须过量的原因是
置换出废液中所有的铜和铁
置换出废液中所有的铜和铁
(2)据图1写出步骤①中任一反应的化学方程式为
Zn+CuSO4═Cu+ZnSO4(Zn+FeSO4═Fe+ZnSO4)
Zn+CuSO4═Cu+ZnSO4(Zn+FeSO4═Fe+ZnSO4)
(3)检验图1步骤④中加入的稀硫酸是否足量的方法是
在D中加入稀硫酸,如果无气体产生,则步骤4中硫酸是足量的
在D中加入稀硫酸,如果无气体产生,则步骤4中硫酸是足量的
(4)指出如图2的过滤操作的错误
未用玻璃棒引流烧杯中的液体,滤纸边缘高于漏斗边缘
未用玻璃棒引流烧杯中的液体,滤纸边缘高于漏斗边缘
(5)若实验过程中的物质损失忽略,最终所得硫酸锌的质量
大于
大于
(填“大于”、“小于”或“等于”)原废液中硫酸锌的质量.要计算该废液中硫酸铜质量,必须要称量固体D
固体D
的质量.分析:(1)锌比铜、铁活泼,能够把亚铁离子、铜离子从溶液中置换出来;
(2)根据反应物、生成物及其质量守恒定律可以书写化学方程式;
(3)锌和稀硫酸反应能生成氢气;
(4)过滤时要注意一贴、二低、三靠.一贴是指滤纸紧贴漏斗内壁.二低是指滤纸低于漏斗边缘,液面低于滤纸边缘.三靠是指上面的烧杯紧靠玻璃棒,玻璃棒紧靠三层滤纸一面,漏斗末端紧靠烧杯内壁;
(5)因为①中加入了锌粉,若实验过程中的物质损失忽略,最终所得硫酸锌的质量应该大于原废液中硫酸锌的质量,要计算该废液中硫酸铜质量,必须要称量铜的质量.
(2)根据反应物、生成物及其质量守恒定律可以书写化学方程式;
(3)锌和稀硫酸反应能生成氢气;
(4)过滤时要注意一贴、二低、三靠.一贴是指滤纸紧贴漏斗内壁.二低是指滤纸低于漏斗边缘,液面低于滤纸边缘.三靠是指上面的烧杯紧靠玻璃棒,玻璃棒紧靠三层滤纸一面,漏斗末端紧靠烧杯内壁;
(5)因为①中加入了锌粉,若实验过程中的物质损失忽略,最终所得硫酸锌的质量应该大于原废液中硫酸锌的质量,要计算该废液中硫酸铜质量,必须要称量铜的质量.
解答:解:(1)步骤①中锌粉必须过量的原因是:将废液中的Cu2+和Fe2+全部置换出来;
(2)锌和硫酸铜反应能生成硫酸锌和铜,锌和硫酸亚铁反应能生成硫酸锌和铁,反应的化学方程式分别为:Zn+CuSO4=ZnSO4+Cu、Zn+FeSO4═ZnSO4+Fe;
(3)检验步骤④中加入的稀硫酸是否足量的方法是:继续加入少量稀硫酸,观察是否有气泡产生,如果没有气泡产生,说明稀硫酸足量;
(4)如图2过滤操作中的错误有:没用玻璃棒引流、滤纸边缘高于漏斗口.
(5)若实验过程中的物质损失忽略,因为锌与硫酸铜反应生成铜和硫酸锌,锌与硫酸亚铁反应生成铁和硫酸锌,生成了很多的硫酸锌,最终所得硫酸锌的质量大于原废液中硫酸锌的质量;要计算该废液中硫酸铜质量,必须要称量固体D的质量,固体D是铜.
故答案为:(1)置换出废液中所有的铜和铁;(2)Zn+CuSO4═Cu+ZnSO4(Zn+FeSO4═Fe+ZnSO4);(3)在D中加入稀硫酸,如果无气体产生,则步骤4中硫酸是足量的;(4)未用玻璃棒引流烧杯中的液体,滤纸边缘高于漏斗边缘;(5)大于;固体D.
(2)锌和硫酸铜反应能生成硫酸锌和铜,锌和硫酸亚铁反应能生成硫酸锌和铁,反应的化学方程式分别为:Zn+CuSO4=ZnSO4+Cu、Zn+FeSO4═ZnSO4+Fe;
(3)检验步骤④中加入的稀硫酸是否足量的方法是:继续加入少量稀硫酸,观察是否有气泡产生,如果没有气泡产生,说明稀硫酸足量;
(4)如图2过滤操作中的错误有:没用玻璃棒引流、滤纸边缘高于漏斗口.
(5)若实验过程中的物质损失忽略,因为锌与硫酸铜反应生成铜和硫酸锌,锌与硫酸亚铁反应生成铁和硫酸锌,生成了很多的硫酸锌,最终所得硫酸锌的质量大于原废液中硫酸锌的质量;要计算该废液中硫酸铜质量,必须要称量固体D的质量,固体D是铜.
故答案为:(1)置换出废液中所有的铜和铁;(2)Zn+CuSO4═Cu+ZnSO4(Zn+FeSO4═Fe+ZnSO4);(3)在D中加入稀硫酸,如果无气体产生,则步骤4中硫酸是足量的;(4)未用玻璃棒引流烧杯中的液体,滤纸边缘高于漏斗边缘;(5)大于;固体D.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.所以,对化学实验不仅要认真观察,还应掌握设计实验、观察实验现象的方法.

练习册系列答案
 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目