题目内容
【题目】(10分)某校化学小组对热水壶底部水垢的主要成分进行了如下探究,请完成以下活动并回答相关问题。
【查阅资料】
天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质——水垢(主要成分为碳酸盐和碱)。有关物质的溶解性见下表(20℃):
阴离子 阳离子 | OH- | CO32- | HCO3- |
Ca2+ | 微溶 | 不溶 | 可溶 |
Mg2+ | 不溶 | 微溶 | 可溶 |
根据上述物质的溶解性,小组同学确定水垢的主要成分中一定含有的两种物质是 ,可能含有Ca(OH)2和MgCO3。
【提出问题】水垢的主要成分中是否含有Ca(OH)2和MgCO3呢?
【实验方案1】确定水垢中是否含Ca(OH)2
实验步骤 | 实验现象 | 结论 |
在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入Na2CO3溶液。 | _______________ | 水垢中无Ca(OH)2 |
【实验方案2】确定水垢中是否含MgCO3
利用下列实验装置,完成实验2探究。其主要实验步骤如下:
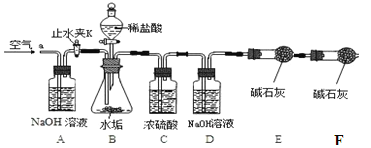
按上图组装后,将9.8g水垢试样放入锥形瓶中,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后精确称量D、E装置总质量为600.0g关闭止水夹K,加入足量稀盐酸溶液,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处再次缓缓鼓入空气,一段时间后称量装置D、E的总质量为604.4g(注意:碱石灰主要成分为CaO和NaOH的混合物)。
【实验讨论】
(1)加入药品前应 ;待锥形瓶中不再产生气泡时,打开止水夹K,缓缓鼓入空气的目的是 。
(2)C装置的作用是: __ 。
(3)装置B中生成CO2的质量为 g。通过计算说明该水垢中 (填序号)含MgCO3。
A.一定 B.一定不 C.可能 D.无法确定
【实验方案3】定量探究水垢中氢氧化镁的质量分数
另取质量为9.8g的水垢试样,加入7.3%稀盐酸与之恰好完全反应,测得消耗稀盐酸110 g。结合以上数据和实验结论,计算水垢样品中氢氧化镁的质量分数(写出计算过程,结果保留1位小数)。
【反思】缺少F装置会使所测水垢样品中氢氧化镁的质量分数 _____________(填写“偏大”或“偏小”或“不变”)。
【答案】Ca(HCO3)2和Mg(HCO3)2 无白色沉淀
(1)检查装置气密性 将生成的二氧化碳全部被氢氧化钠溶液吸收
(2)吸水
(3)4.4 A
【实验方案3】设用于产生二氧化碳所消耗盐酸质量为X,氢氧化镁质量为Y
CaCO3+ 2 HCl == CaCl2 + CO2↑+ H2O
73 44
7.3%X 4.4克
73/44=7.3%X/4.4克 X=100克
则与氢氧化镁反应消耗盐酸质量为10克
Mg(OH)2+2HCl==MgCl2+2H2O
58 73
Y 10g×7.3%
58/73=Y/ 10g×7.3% Y=0.58 g
则氢氧化镁的质量分数= 0.58 g/ 9.8g ×100%=5.9%
【反思】偏小
【解析】
试题分析:【查阅资料】根据溶解性表可知,水垢的主要成分中一定含有的两种物质是碳酸氢钙和碳酸氢镁【实验方案1】碳酸钠与氢氧化钙反应,生成碳酸钙白色沉淀,若没有产生白色沉淀,则证明不含氢氧化钙;
【实验讨论】(1)加入药品前应先检查装置气密性;鼓入空气目的是将生成的二氧化碳全部被氢氧化钠溶液吸收
(2)浓硫酸具有吸水性,能除去气体中的水分。
(3)根据题意知,反应前后增加的质量即为生成二氧化碳质量,然后根据二氧化碳质量,利用化学方程式计算出需要碳酸钙质量即可。具体步骤如下:
设生成4.4克二氧化碳需要碳酸钙质量为X
CaCO3+ 2 HCl == CaCl2 + CO2↑+ H2O
100 44
X 4.4克
100/44=X/4.4克 X=10克
而水垢质量为9.8g,则说明水垢中一定含有碳酸镁。故选A
【实验方案3】设用于产生二氧化碳所消耗盐酸质量为X,氢氧化镁质量为Y
CaCO3+ 2 HCl == CaCl2 + CO2↑+ H2O
73 44
7.3%X 4.4克
73/44=7.3%X/4.4克 X=100克
则与氢氧化镁反应消耗盐酸质量为10克
Mg(OH)2+2HCl==MgCl2+2H2O
59 73
Y 10g×7.3%
58/73=Y/ 10g×7.3% Y=0.58 g
则氢氧化镁的质量分数= 0.58 g/ 9.8g ×100%=5.9%
【反思】 缺少F装置就会使所测得二氧化碳质量增大,则碳酸钙与稀盐酸反应时,消耗稀盐酸质量增大,从而使与氢氧化镁反应消耗盐酸质量减少,最后得出氢氧化镁质量就减少,所得氢氧化镁溶质质量分数就偏小。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案